
Structure, propriétés, utilisations de l'hydroxyde de strontium (Sr (OH),)

le hydroxyde de strontium (Sr (OH) ₂) est un composé chimique inorganique composé d'un ion strontium (Sr) et de deux ions hydroxyde (OH). Ce composé est obtenu en combinant un sel de strontium avec une base forte, résultant en un composé alcalin dont la formule chimique est Sr (OH)deux.
Généralement, pour la préparation d'hydroxyde de strontium, l'hydroxyde de sodium (NaOH) ou l'hydroxyde de potassium (KOH) est utilisé comme base forte. D'autre part, le sel de strontium (ou ion strontium) qui réagit avec la base forte est le nitrate de strontium Sr (NO3)deux et le processus est décrit par la réaction chimique suivante:
2KOH + Sr (NON3)deux → 2KNO3 + Sr (OH)deux
En solution, le cation strontium (Sr+) entre en contact avec l'anion hydroxyde (OH-) formant un sel ionique basique de strontium. Puisque le strontium est un métal alcalino-terreux, l'hydroxyde de strontium est considéré comme un composé alcalin caustique..
Index des articles
- 1 Obtention
- 2 Structure chimique et propriétés physico-chimiques
- 2.1 Hydroxyde de strontium octahydraté
- 2.2 Hydroxyde de strontium monohydraté
- 2.3 Hydroxyde de strontium anhydre
- 2.4 Solubilité
- 2.5 Réactivité chimique
- 3 utilisations
- 3.1 Extraction de mélasse et raffinage du sucre de betterave
- 3.2 Graisses de strontium
- 3.3 Stabilisateur en plastique
- 3.4 Autres applications
- 4 Références
Obtention
En plus du procédé expliqué précédemment, on peut dire qu'une fois la réaction effectuée, Sr (OH)deux précipite hors de la solution. Ensuite, il est soumis au processus de lavage et de séchage, obtenant finalement une poudre blanche très fine..
Une autre méthode pour obtenir de l'hydroxyde de strontium consiste à chauffer le carbonate de strontium (SrCO3) ou du sulfate de strontium (SrSO4) avec de la vapeur à une température comprise entre 500 ° C et 600 ° C La réaction chimique se produit comme indiqué ci-dessous:
SrCO3 + HdeuxO → Sr (OH)deux + COdeux
SrS + 2HdeuxO → Sr (OH)deux + HdeuxS
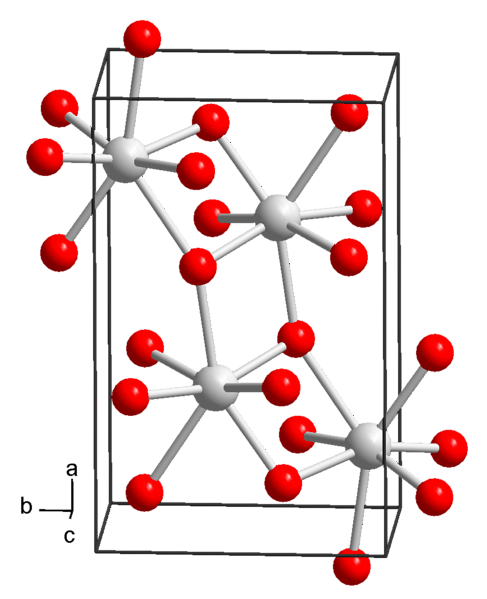
Structure chimique et propriétés physico-chimiques
Actuellement 3 formes d'hydroxyde de strontium sont connues: octahydraté, monohydraté et anhydre.
Hydroxyde de strontium octahydraté
L'hydroxyde de strontium précipite sous forme octahydratée à partir de solutions dans des conditions normales de température et de pression (25 ° C et 1 atm), dont la formule chimique est Sr (OH)deux∙ 8HdeuxOU ALORS.
Ce composé a une masse molaire de 265,76 g / mol, une densité de 1,90 g / cm et précipite sous forme de cristaux tétragonaux (de groupe spatial P4 / ncc) avec un aspect prismatique quadrangulaire et incolore..
De même, l'hydroxyde de strontium octahydraté a la capacité d'absorber l'humidité atmosphérique, car il s'agit d'un composé facilement déliquescent..
Hydroxyde de strontium monohydraté
Selon des études de microscopie optique (réalisées à l'aide de la technique de diffraction des rayons X), en élevant la température à environ 210 ° C - à pression atmosphérique constante - Sr (OH)deux∙ 8HdeuxOu il est déshydraté et transformé en hydroxyde de strontium monohydraté (Sr (OH)deux∙ HdeuxOU ALORS).
Cette forme du composé a une masse molaire de 139,65 g / mol et sa température de fusion est de -73,15 ° C (375 K). En raison de sa configuration atomique, il a moins de solubilité dans l'eau que celui décrit sous sa forme octahydratée..
Hydroxyde de strontium anhydre
En continuant à augmenter la température du système jusqu'à environ 480 ° C, la déshydratation est prolongée jusqu'à l'obtention d'un hydroxyde de strontium anhydre.
Contrairement à ses formes hydratées, il a une masse molaire de 121,63 g / mol et une densité de 3,625 g / cm.3. Son point d'ébullition est atteint à 710 ° C (1310 ° F ou 983 K) tandis que le point de fusion est à 535 ° C (995 ° F ou 808 K).
Solubilité
L'hydroxyde de strontium octahydraté a une solubilité dans l'eau de 0,91 gramme pour 100 millilitres (mesurée à 0 ° C), tandis que sa forme anhydre à des conditions de température similaires a une solubilité de 0,41 gramme pour 100 millilitres.
De même, cette substance est considérée comme insoluble dans l'acétone et totalement soluble dans les acides et le chlorure d'ammonium..
Réactivité chimique
L'hydroxyde de strontium n'est pas inflammable, sa réactivité chimique reste stable à des températures et pressions modérées, et il est capable d'absorber le dioxyde de carbone de l'air atmosphérique, le transformant en carbonate de strontium..
De plus, c'est un composé très irritant s'il entre en contact avec la peau, les voies respiratoires ou d'autres zones muqueuses du corps..
Applications
En raison de ses caractéristiques hygroscopiques et de ses propriétés de base, l'hydroxyde de strontium est utilisé pour différentes applications dans l'industrie:
- Extraction de mélasse et raffinage du sucre de betteraves.
- Stabilisateur en plastique.
- Graisses et lubrifiants.
Extraction de mélasse et raffinage du sucre de betterave
Au début du 21e siècle, en Allemagne, l'hydroxyde de strontium a commencé à être utilisé pour le raffinage du sucre de betteraves grâce au procédé breveté par Carl Scheibler en 1882.
Cette procédure consiste en un mélange d'hydroxyde de strontium et de pulpe de sucre de betterave, ce qui conduit à un disaccharide insoluble. Cette solution est séparée par décantation et une fois le processus de raffinage effectué, le sucre est obtenu comme produit final..
Bien que cette procédure soit toujours utilisée aujourd'hui, il existe d'autres méthodes beaucoup plus demandées, car moins chères, qui sont utilisées dans la grande majorité des raffineries de sucre dans le monde. Par exemple, la méthode Barsil, qui utilise du silicate de baryum ou la méthode Steffen utilisant Cal comme agent d'extraction..
Graisses de strontium
Ce sont des graisses lubrifiantes contenant de l'hydroxyde de strontium. Ceux-ci sont capables d'adhérer fortement aux surfaces aux caractéristiques métalliques, résistent à l'eau et résistent aux changements brusques de température..
En raison de leur bonne stabilité physique et chimique, ces graisses sont utilisées comme lubrifiants industriels.
Stabilisateur en plastique
La grande majorité des plastiques, lorsqu'ils sont exposés à des facteurs climatiques tels que le soleil, la pluie et l'oxygène atmosphérique, modifient leurs propriétés et se détériorent.
En raison de sa résistance considérable à l'eau, de l'hydroxyde de strontium est ajouté à ces polymères - pendant la phase de fusion - agissant comme stabilisant dans la fabrication de produits en plastique pour prolonger leur durée de vie utile..
Autres applications
- Dans l'industrie de la peinture, il est utilisé comme additif essentiel pour accélérer le processus de séchage des peintures commerciales et industrielles..
- Les sels ou ions de strontium sont obtenus à partir d'hydroxyde de strontium, qui sont utilisés comme matière première pour la production d'articles pyrotechniques..
Les références
- Wikipédia. (n.d.). Hydroxyde de strontium. Récupéré de en.wikipedia.org
- PubChem. (s.f.). Hydroxyde de strontium. Récupéré de pubchem.ncbi.nlm.nih.gov
- Lambert, I. et Clever, H. L. (2013). Hydroxydes alcalino-terreux dans l'eau et les solutions aqueuses. Récupéré de books.google.co.ve
- Krebs, R. E. (2006). L'histoire et l'utilisation des éléments chimiques de notre Terre: un guide de référence. Obtenu sur books.google.co.ve
- Honeywell. (s.f.). Hydroxyde de strontium octahydraté. Récupéré de honeywell.com



Personne n'a encore commenté ce post.