
Formule, propriétés et utilisations de l'ion ammonium (NH4 +)

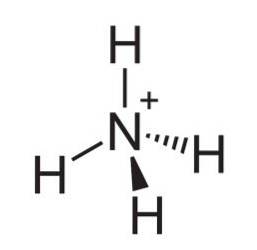
le ion ammonium est un cation polyatomique chargé positivement dont la formule chimique est NH4+. La molécule n'est pas plate, mais a la forme d'un tétraèdre. Les quatre atomes d'hydrogène composent les quatre coins.
L'azote ammoniacal a une paire d'électrons non partagés capable d'accepter un proton (base de Lewis), donc l'ion ammonium est formé par la protonation de l'ammoniac selon la réaction: NH3 + H+ → NH4+
Le nom ammonium est également donné aux amines substituées ou aux cations ammonium substitués. Par exemple, le chlorure de méthylammonium est un sel ionique de formule CH3NH4Cl où l'ion chlorure est attaché à une méthylamine.
L'ion ammonium a des propriétés très similaires à celles des métaux alcalins plus lourds et est souvent considéré comme un proche parent. L'ammonium devrait se comporter comme un métal à très haute pression, comme à l'intérieur de planètes géantes gazeuses comme Uranus et Neptune..
L'ion ammonium joue un rôle important dans la synthèse des protéines dans le corps humain. En bref, tous les êtres vivants ont besoin de protéines, qui sont composées d'environ 20 acides aminés différents. Alors que les plantes et les micro-organismes peuvent synthétiser la plupart des acides aminés à partir de l'azote dans l'atmosphère, les animaux ne le peuvent pas..
Pour l'homme, certains acides aminés ne peuvent pas du tout être synthétisés et doivent être consommés sous forme d'acides aminés essentiels.
Cependant, d'autres acides aminés peuvent être synthétisés par des micro-organismes dans le tractus gastro-intestinal à l'aide d'ions ammoniac. Ainsi, cette molécule est une figure clé du cycle de l'azote et de la synthèse des protéines..
Index des articles
- 1 Propriétés
- 1.1 Solubilité et poids moléculaire
- 1.2 Propriétés acido-basiques
- 1.3 Sels d'ammonium
- 2 utilisations
- 3 Références
Propriétés
Solubilité et poids moléculaire
L'ion ammonium a un poids moléculaire de 18,039 g / mol et une solubilité de 10,2 mg / ml d'eau (National Center for Biotechnology Information, 2017). La dissolution de l'ammoniac dans l'eau forme l'ion ammonium selon la réaction:
NH3 + HdeuxO → NH4+ + Oh-
Cela augmente la concentration d'hydroxyle dans le milieu en augmentant le pH de la solution (Royal Society of Chemistry, 2015).
Propriétés de base acide
L'ion ammonium a un pKb de 9,25. Cela signifie qu'à un pH supérieur à cette valeur, il aura un comportement acide et à un pH inférieur, il aura un comportement basique..
Par exemple, lors de la dissolution de l'ammoniac dans l'acide acétique (pKa = 4,76), la paire d'électrons libres d'azote prend un proton du milieu, augmentant la concentration d'ions hydroxyde selon l'équation:
NH3 + CH3COOH ⇌ NH4+ + CH3ROUCOULER-
Cependant, en présence d'une base forte, telle que l'hydroxyde de sodium (pKa = 14,93), l'ion ammonium cède un proton au milieu selon la réaction:
NH4+ + NaOH ⇌ NH3 + N / A+ + HdeuxOU ALORS
En conclusion, à un pH inférieur à 9,25, l'azote sera protoné, tandis qu'à un pH supérieur à cette valeur, il sera déprotoné. Ceci est de la plus haute importance pour comprendre les courbes de titrage et comprendre le comportement de substances telles que les acides aminés..
Sels d'ammonium
L'une des propriétés les plus caractéristiques de l'ammoniac est son pouvoir de se combiner directement avec des acides pour former des sels en fonction de la réaction:
NH3 + HX → NH4X
Ainsi, avec l'acide chlorhydrique, il forme du chlorure d'ammonium (NH4Cl); Avec de l'acide nitrique, du nitrate d'ammonium (NH4NE PAS3), avec l'acide carbonique, il formera du carbonate d'ammonium ((NH4)deuxCO3) etc.
Il a été démontré que l'ammoniac parfaitement sec ne se combine pas avec de l'acide chlorhydrique parfaitement sec, l'humidité étant nécessaire pour provoquer la réaction (VIAS Encyclopedia, 2004).
La plupart des sels d'ammonium simples sont très solubles dans l'eau. Une exception est l'hexachloroplatinate d'ammonium, dont la formation est utilisée comme test d'ammonium. Les sels de nitrate d'ammonium et en particulier de perchlorate sont hautement explosifs, dans ces cas l'ammonium est l'agent réducteur.
Dans un processus inhabituel, les ions ammonium forment un amalgame. Ces espèces sont préparées par électrolyse d'une solution d'ammonium à l'aide d'une cathode à mercure. Cet amalgame se décompose finalement pour libérer de l'ammoniac et de l'hydrogène (Johnston, 2014).
L'un des sels d'ammonium les plus courants est l'hydroxyde d'ammonium, qui est simplement de l'ammoniac dissous dans l'eau. Ce composé est très commun et se trouve naturellement dans l'environnement (dans l'air, l'eau et le sol) et dans toutes les plantes et animaux, y compris les humains..
Applications
L'ammonium est une source importante d'azote pour de nombreuses espèces végétales, en particulier celles qui poussent dans des sols hypoxiques. Cependant, il est également toxique pour la plupart des espèces cultivées et est rarement appliqué comme seule source d'azote (Database, Human Metabolome, 2017).
L'azote (N), lié aux protéines de la biomasse morte, est consommé par les micro-organismes et converti en ions ammonium (NH4 +) qui peuvent être directement absorbés par les racines des plantes (par exemple le riz).
Les ions ammonium sont généralement convertis en ions nitrite (NO2-) par les bactéries nitrosomonas, suivis d'une seconde conversion en nitrate (NO3-) par les bactéries Nitrobacter..
Les trois principales sources d'azote utilisées en agriculture sont l'urée, l'ammonium et le nitrate. L'oxydation biologique de l'ammonium en nitrate est connue sous le nom de nitrification. Ce processus comporte plusieurs étapes et est médiatisé par des bactéries aérobies et autotrophes obligatoires..
Dans les sols inondés, l'oxydation du NH4 + est limitée. L'urée est décomposée par l'enzyme uréase ou hydrolysée chimiquement en ammoniac et en CO2.
Dans l'étape d'ammonification, l'ammoniac est converti par des bactéries ammonifiantes en ion ammonium (NH4 +). Dans l'étape suivante, l'ammonium est converti par des bactéries nitrifiantes en nitrate (nitrification).
Cette forme d'azote très mobile est le plus souvent absorbée par les racines des plantes, ainsi que par les micro-organismes du sol..
Pour fermer le cycle de l'azote, l'azote gazeux de l'atmosphère est converti en azote de la biomasse par les bactéries Rhizobium qui vivent dans les tissus racinaires des légumineuses (par exemple, la luzerne, les pois et les haricots) et les légumineuses (comme l'aulne). Et par les cyanobactéries et Azotobacter (Sposito, 2011).
Grâce à l'ammonium (NH4 +), les plantes aquatiques peuvent absorber et incorporer l'azote dans les protéines, les acides aminés et d'autres molécules. Des concentrations élevées d'ammoniac peuvent augmenter la croissance des algues et des plantes aquatiques.
L'hydroxyde d'ammonium et d'autres sels d'ammonium sont largement utilisés dans la transformation des aliments. La réglementation de la Food and Drug Administration (FDA) stipule que l'hydroxyde d'ammonium est sans danger ("généralement reconnu comme sûr" ou GRAS) en tant qu'agent de levure, agent de contrôle du pH et agent de finition..
La liste des aliments dans lesquels l'hydroxyde d'ammonium est utilisé comme additif alimentaire direct est longue et comprend des produits de boulangerie, des fromages, des chocolats, d'autres produits de confiserie (par exemple des bonbons) et des poudings. L'hydroxyde d'ammonium est également utilisé comme agent antimicrobien dans les produits carnés.
L'ammoniac sous d'autres formes (p. Ex. Sulfate d'ammonium, alginate d'ammonium) est utilisé dans les assaisonnements, les isolats de protéines de soja, les collations, les confitures et les gelées et les boissons non alcoolisées (PNA potassium nitrate association, 2016).
La mesure de l'ammonium est utilisée dans le test RAMBO, particulièrement utile pour diagnostiquer la cause de l'acidose (Test ID: RAMBO Ammonium, Random, Urine, S.F.). Le rein régule l'excrétion d'acide et l'équilibre systémique acido-basique.
Changer la quantité d'ammoniac dans l'urine est un moyen important pour les reins de le faire. La mesure du niveau d'ammoniac dans l'urine peut fournir un aperçu de la cause d'un trouble de l'équilibre acido-basique chez les patients..
Le niveau d'ammoniac dans l'urine peut également fournir de nombreuses informations sur la production quotidienne d'acide chez un patient donné. Étant donné que la majeure partie de la charge acide d'un individu provient des protéines ingérées, la quantité d'ammoniac dans l'urine est un bon indicateur de l'apport en protéines alimentaires..
Les mesures d'ammoniaque dans l'urine peuvent être particulièrement utiles pour le diagnostic et le traitement des patients atteints de calculs rénaux:
- Des niveaux élevés d'ammoniac dans l'urine et un pH urinaire bas suggèrent des pertes gastro-intestinales continues. Ces patients sont à risque de calculs d'acide urique et d'oxalate de calcium..
- Un peu d'ammoniaque dans l'urine et un pH élevé de l'urine suggèrent une acidose tubulaire rénale. Ces patients sont à risque de calculs de phosphate de calcium.
- Les patients présentant des calculs d'oxalate de calcium et de phosphate de calcium sont souvent traités avec du citrate pour augmenter le citrate urinaire (un inhibiteur naturel de l'oxalate de calcium et de la croissance des cristaux de phosphate de calcium)..
Cependant, comme le citrate est métabolisé en bicarbonate (une base), ce médicament peut également augmenter le pH de l'urine. Si le pH de l'urine est trop élevé avec un traitement au citrate, le risque de calculs de phosphate de calcium peut être augmenté par inadvertance..
La surveillance de l'urine pour l'ammoniac est une façon de titrer la dose de citrate et d'éviter ce problème. Une bonne dose de départ de citrate représente environ la moitié de l'excrétion d'ammonium dans l'urine (en mEq de chaque).
L'effet de cette dose sur les valeurs d'ammonium, de citrate et de pH dans l'urine peut être surveillé et la dose de citrate ajustée en fonction de la réponse. Une baisse de l'ammoniac urinaire devrait indiquer si le citrate actuel est suffisant pour neutraliser partiellement (mais pas complètement) la charge acide quotidienne de ce patient donné..
Les références
- Base de données, métabolome humain. (2017, 2 mars). Affichage de la metabocard pour l'ammonium. Récupéré de: hmdb.ca.
- Johnston, F. J. (2014). Sel d'ammonium. récupéré de accessscience: accessscience.com.
- Centre national d'information sur la biotechnologie. (2017, 25 février). Base de données des composés PubChem; CID = 16741146. Récupéré de PubChem.
- Association de nitrate de potassium PNA. (2016). Nitrate (NO3-) contre ammonium (NH4 +). récupéré sur kno3.org.
- Société royale de chimie. (2015). Ion ammonium. Récupéré de chemspider: chemspider.com.
- Sposito, G. (2 septembre 2011). Sol. Récupéré de l'encyclopédie britannica: britannica.com.
- ID du test: RAMBO Ammonium, aléatoire, urine. (S.F.). Récupéré de encyclopediamayomedicallaboratorie.com.
- Encyclopédie VIAS. (2004, 22 décembre). Sels d'ammonium. Récupéré de l'encyclopédie vias.org.



Personne n'a encore commenté ce post.