
Caractéristiques, structure et exemples de l'isopropyle
le isopropyle ou isopropyle est un groupe ou substituant alkyle, l'un des plus courants et des plus simples trouvés en chimie organique. C'est l'un des isomères structuraux du propyle, CH3CHdeuxCHdeux-, groupe dérivé du propane, CH3CHdeuxCH3. Son squelette pourrait être écrit comme (CH3)deuxCH-, montrant qu'il a également trois carbones.
L'isopropyle lorsqu'il se trouve dans de grosses molécules est simplifié avec le symbole iPr; bien que dans les petits composés, ce ne soit pas nécessaire et il est très facile de l'identifier. On peut en tirer une variété de composés organiques qui, bien que simples en apparence, sont polyvalents pour différentes applications; parmi eux, l'alcool isopropylique, (CH3)deuxCHOH.

Ci-dessus, le squelette carboné du groupe isopropyle. Notez qu'au centre, nous avons le carbone «secondaire», qui est lié à deux groupes méthyle, CH3, à un hydrogène et à un segment inconnu représenté par des sinuosités; Ceux-ci peuvent être un hétéroatome, un groupe fonctionnel, une chaîne aliphatique (R), un cycle aromatique (Ar), etc..
S'il est observé, le groupe isopropyle ressemble à un Y, une caractéristique essentielle pour le reconnaître à première vue lorsqu'on considère toute structure moléculaire. Plus l'isopropyle est petit par rapport à la molécule dont il fait partie, on dit qu'il agit simplement comme un substituant, ce qui se produit dans de nombreux composés.
Index des articles
- 1 Fonctionnalités
- 2 Structure
- 3 Exemples de composés avec l'isopropyle
- 3.1 Alcool isopropylique
- 3.2 Halogénures d'isopropyle
- 3.3 Isopropylamine
- 3.4 Lorcaïnide
- 3.5 Autres
- 4 Références
Caractéristiques
Impliquant un peu plus la nature chimique du groupement isopropyle, on peut ajouter qu'en plus d'être alkyle (et aliphatique), c'est-à-dire composé uniquement d'atomes de carbone et d'hydrogène, il est apolaire. En effet, toutes ses liaisons, C-H et C-C, sont de faible polarité, il n'y a donc pas de régions riches ou pauvres en électrons (dipôles).
L'apolarité de l'isopropyle ne signifie pas qu'il est pauvre en électrons; au contraire, en tant que substituant, il les donne aux atomes les plus électronégatifs. C'est pourquoi partout où nous voyons le Y dans une molécule, nous saurons qu'il a donné une densité électronique à son environnement; bien que le résultat final soit une zone sans dipôle.
L'isopropyle est également dit aliphatique car il manque d'aromaticité, trouvé dans les cycles avec des doubles liaisons conjuguées (type benzène).
Concernant son nom, l'origine du préfixe iso sera expliquée dans la section suivante. Cependant, son nom IUPAC devient 1-méthyléthyle, car dans le deuxième carbone de la chaîne éthyle, -CHdeuxCH3, on substitue un H à un groupe méthyle, -CH (CH3) CH3, qui peut aussi s'écrire -CH (CH3)deux.
Structure
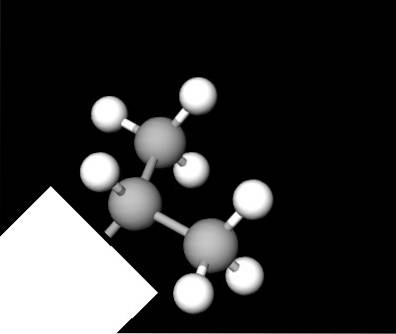
La structure du groupe isopropyle est illustrée ci-dessus, représentée par un modèle de sphères et de barres. Dans celui-ci, nous apprécions à nouveau le Y; mais ce n'est pas plat comme on pourrait le penser au début. La boîte blanche agit comme les sinuosités de la première image, cachant l'autre segment de la molécule quel que soit le composé..
Tous les atomes de carbone ont une hybridation chimique sp3, il ne leur est donc pas possible de résider sur le même plan. Les liaisons C-C ont un angle approximatif de 109,5 °, ce qui déforme les extrémités du Y un peu au-dessous ou au-dessus de son plan hypothétique..
Cette vue de sa structure est très utile car elle la rend encore plus facile à reconnaître lorsque l'on regarde d'autres modèles moléculaires..
Si un plan miroir était dessiné au milieu du carbone CH, on verrait que les groupes méthyle sont "réfléchis" des deux côtés du miroir. Par conséquent, ce plan divise le groupe -CH (CH3)deux en deux moitiés identiques; un fait qui ne se produirait pas avec le propyle, car il s'agit d'une chaîne droite. De là vient le préfixe iso-, de «égal», utilisé pour ce substituant alkyle.
Exemples de composés avec isopropyle
Alcool isopropylique
L'alcool isopropylique est peut-être le dérivé isopropylique le plus notable, car c'est aussi l'alcool secondaire le plus simple, largement commercialisé dans des bouteilles en plastique dans les pharmacies comme solution antiseptique. Sa structure est:
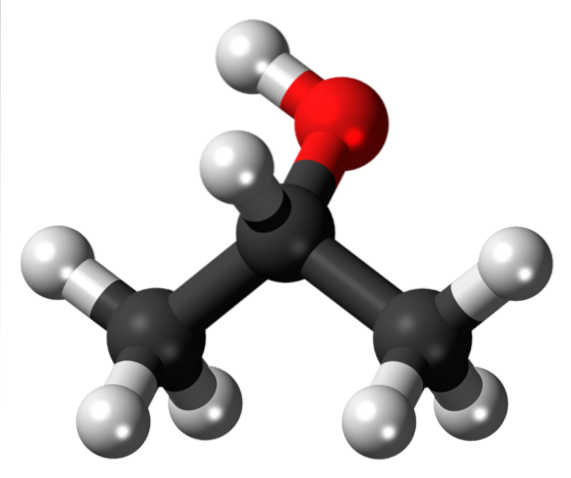
Notez qu'au centre, sous le groupe OH (rouge), nous retrouvons le Y, donnant la fausse apparence d'être plat. Cet alcool est obtenu simplement en changeant les sinuosités ou la boîte blanche déjà montrée par le groupe OH. Il en va de même pour les autres groupes ou hétéroatomes.
Halogénures d'isopropyle
Supposons maintenant que ce ne soit pas l'OH mais un atome d'halogène X (F, Cl, Br et I). Dans ce cas, on obtient les halogénures d'isopropyle, XCH (CH3)deux. Ces composés organiques sont caractérisés en ce qu'ils sont des liquides hautement volatils, éventuellement utilisés comme sources isopropyliques dans des réactions d'alkylation (leur ajout à d'autres molécules)..
Parmi ces halogénures, nous avons donc:
-Fluorure d'isopropyle, FCH (CH3)deux
-Chlorure d'isopropyle, ClCH (CH3)deux
-Bromure d'isopropyle, BrCH (CH3)deux
-Iodure d'isopropyle, ICH (CH3)deux
Ses structures sont identiques à celle de l'alcool isopropylique, ne modifiant que la taille des atomes attachés au carbone central ou secondaire..
Isopropylamine
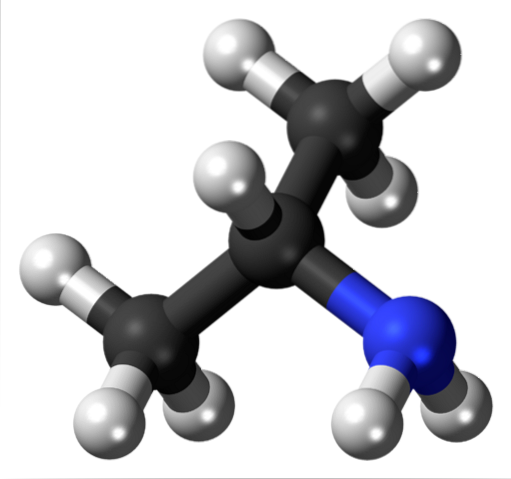
Maintenant, il ne s'agit pas de OH ou des halogènes, mais du groupe fonctionnel amino, NHdeux (image du haut). Comme pour l'alcool isopropylique, l'isopropylamine est une amine secondaire et un point de départ pour la synthèse de divers insecticides. Il n'est pas commercialisé de la même manière, car il est puant et inflammable, étant donc un composé dangereux.
Lorcainida

Nous avons laissé les dérivés isopropyliques derrière nous et avons commencé à les considérer comme un simple substituant. Le lorcaïnide (ci-dessus) est un médicament controversé utilisé pour normaliser les rythmes cardiaques. Si la molécule est observée, il sera facile en quelques secondes de voir le Y à sa gauche, qui représente l'isopropyle.
Dans certaines formules, le symbole iPr est utilisé à la place de Y; mais il est généralement appliqué pour des molécules encore plus volumineuses et compliquées.
Autres
Enfin, d'autres exemples avec leurs formules ou modèles de structure respectifs seront cités pour servir d'exercice pour localiser l'isopropyle:

Le Y de l'isopropyle est maintenant situé sur le côté droit selon cette représentation de la mazapertine, un médicament antipsychotique.
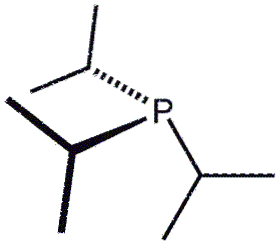
Cette fois, nous avons trois groupes isopropyle, P (CH (CH3)deux)3, représenté par trois Y. La formule pourrait également être écrite sous la forme PiPr3 o P (iPr)3.
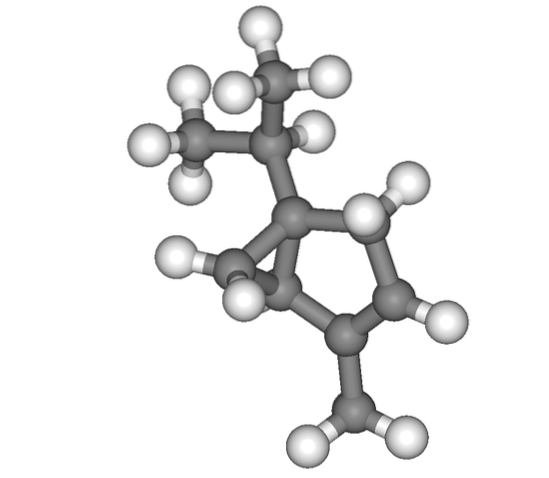
Et enfin, nous avons le monoterpène thuyen, dont la structure à première vue peut prêter à confusion quant à l'endroit où se trouve l'isopropyle. Mais après l'avoir regardé calmement, vous remarquerez que c'est au sommet.
Les références
- Morrison, R. T. et Boyd, R, N. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Interamericana.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (10e édition.). Wiley plus.
- Steven A. Hardinger. (2017). Glossaire illustré de chimie organique: isopropyle. Récupéré de: chem.ucla.edu
- Elsevier B.V. (2019). Groupe isopropyle. ScienceDirect. Récupéré de: sciencedirect.com
- Wikipédia. (2019). Catégorie: Composés isopropyliques. Récupéré de: en.wikipedia.org


Personne n'a encore commenté ce post.