
Loi des applications d'action de masse, exemples
La loi de l'action de masse établit la relation entre les masses actives des réactifs et celle des produits, dans des conditions d'équilibre et dans des systèmes homogènes (solutions ou phases gazeuses). Il a été formulé par les scientifiques norvégiens C.M. Guldberg et P. Waage, qui ont reconnu que l'équilibre est dynamique et non statique.
Pourquoi dynamique? Parce que les taux des réactions directes et inverses sont égaux. Les masses actives sont généralement exprimées en mol / L (molarité). Une telle réaction peut s'écrire comme ceci: aA + bB <=> cC + dD. Pour l'équilibre mentionné dans cet exemple, la relation entre les réactifs et les produits est illustrée dans l'équation de l'image ci-dessous.
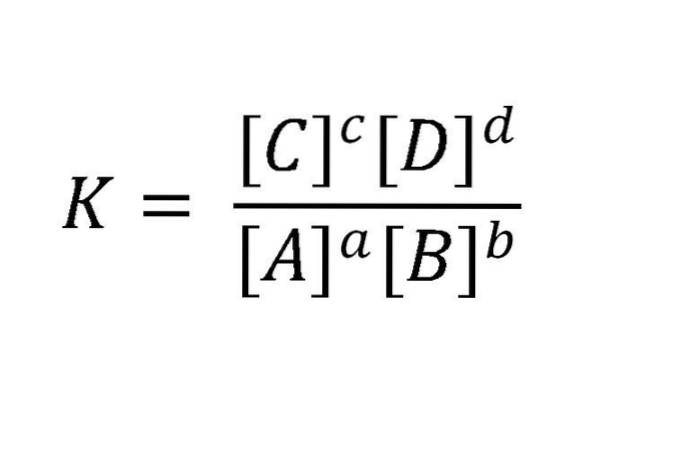
K est toujours constant, quelles que soient les concentrations initiales des substances, tant que la température ne varie pas. Ici, A, B, C et D sont les réactifs et les produits; tandis que a, b, c et d sont leurs coefficients stoechiométriques.
La valeur numérique de K est une constante caractéristique pour chaque réaction à une température donnée. Alors, K est ce qu'on appelle la constante d'équilibre.
La notation [] signifie que dans l'expression mathématique les concentrations apparaissent en unités de mol / L, élevées à une puissance égale au coefficient de réaction.
Index des articles
- 1 Quelle est la loi de l'action de masse?
- 1.1 Signification de la constante d'équilibre
- 2 Équilibre chimique
- 2.1 Équilibre dans des systèmes hétérogènes
- 2.2 Déplacements d'équilibre
- 3 Principe de Le Chatelier
- 4 applications
- 5 Exemples de la loi de l'action de masse
- 6 La loi de l'action de masse en pharmacologie
- 7 Limitations
- 8 Références
Quelle est la loi de l'action de masse?
Comme mentionné précédemment, la loi d'action de masse exprime que la vitesse d'une réaction donnée est directement proportionnelle au produit des concentrations de l'espèce de réactif, où la concentration de chaque espèce est élevée à une puissance égale à son coefficient stoechiométrique dans le produit chimique équation.
En ce sens, il peut être mieux expliqué en ayant une réaction réversible, dont l'équation générale est illustrée ci-dessous:
aA + bB ↔ cC + dD
Où A et B représentent les réactifs et les substances nommées C et D représentent les produits de la réaction. De même, les valeurs de a, b, c et d représentent les coefficients stoechiométriques de A, B, C et D, respectivement..
En partant de l'équation précédente, on obtient la constante d'équilibre mentionnée précédemment, illustrée par:
K = [C]c[RÉ]ré/[À]à[B]b
Où la constante d'équilibre K est égale à un quotient, dans lequel le numérateur est constitué de la multiplication des concentrations des produits (en état d'équilibre) élevées à leur coefficient dans l'équation équilibrée et le dénominateur consiste en une multiplication similaire mais entre les réactifs élevés au coefficient qui les accompagne.
Signification de la constante d'équilibre
Il est à noter que dans l'équation de calcul de la constante d'équilibre, il faut utiliser les concentrations des espèces en équilibre, tant qu'il n'y a pas de modifications de celles-ci ou de la température du système..
De la même manière, la valeur de la constante d'équilibre renseigne sur la direction qui est favorisée dans une réaction à l'équilibre, c'est-à-dire qu'elle révèle si la réaction est favorable envers les réactifs ou les produits..
Si la grandeur de cette constante est beaucoup plus grande que l'unité (K "1), l'équilibre se déplacera vers la droite et favorisera les produits; tandis que si la grandeur de cette constante est beaucoup plus petite que l'unité (K" 1), l'équilibre sera être incliné vers la gauche et favorisera les réactifs.
Aussi, bien que par convention il soit indiqué que les substances du côté gauche de la flèche sont les réactifs et celles du côté droit sont les produits, le fait que les réactifs qui proviennent de la réaction au sens direct deviennent les produits de la réaction. à l'envers et vice versa.
Balance chimique
Les réactions atteignent souvent un équilibre entre les quantités de substances de départ et celles des produits formés. Cet équilibre peut en outre se déplacer en favorisant l'augmentation ou la diminution de l'une des substances qui participent à la réaction..
Un fait analogue se produit dans la dissociation d'une substance dissoute: lors d'une réaction, la disparition des substances initiales et la formation des produits peuvent être observées expérimentalement à une vitesse variable.
La vitesse d'une réaction dépend fortement de la température et à des degrés divers de la concentration des réactifs. En fait, ces facteurs sont étudiés notamment par la cinétique chimique.
Cependant, cet équilibre n'est pas statique, mais provient de la coexistence d'une réaction directe et d'une réaction inverse..
Dans la réaction directe (->) les produits se forment, tandis que dans la réaction inverse (<-) estos vuelven a originar las sustancias iniciales.
Ce qui précède constitue ce que l'on appelle l'équilibre dynamique, mentionné ci-dessus..
Équilibre dans des systèmes hétérogènes
Dans les systèmes hétérogènes -c'est-à-dire dans ceux formés par plusieurs phases- les concentrations des solides peuvent être considérées comme constantes, en omettant de l'expression mathématique de K.
Voleur3(s) <=> CaO (s) + COdeux(g)
Ainsi, dans l'équilibre de décomposition du carbonate de calcium, sa concentration et celle de l'oxyde résultant peuvent être considérées comme constantes quelle que soit sa masse..
Changements d'équilibre
La valeur numérique de la constante d'équilibre détermine si une réaction favorise ou non la formation de produits. Lorsque K est supérieur à 1, le système d'équilibre aura une concentration plus élevée de produits que de réactifs, et si K est inférieur à 1, l'inverse se produit: à l'équilibre, il y aura une plus grande concentration de réactifs que de produits..
Principe du Chatelier
L'influence des variations de concentration, de température et de pression peut modifier la vitesse d'une réaction.
Par exemple, si des produits gazeux se forment dans une réaction, une augmentation de la pression dans le système provoque le déroulement de la réaction dans la direction opposée (vers les réactifs).
En général, les réactions inorganiques qui ont lieu entre les ions sont très rapides, tandis que les réactions organiques ont des vitesses beaucoup plus faibles..
Si de la chaleur est produite lors d'une réaction, une augmentation de la température extérieure a tendance à l'orienter dans le sens opposé, car la réaction inverse est endothermique (absorbe la chaleur).
De même, si un excès est provoqué dans l'une des substances réactives au sein d'un système en équilibre, les autres substances formeront des produits pour neutraliser au maximum ladite modification..
En conséquence, l'équilibre se décale en favorisant dans un sens ou dans l'autre en augmentant la vitesse de réaction, de telle sorte que la valeur de K reste constante..
Toutes ces influences extérieures et la réponse d'équilibre pour les contrecarrer est ce que l'on appelle le principe de Le Chatelier..
Applications
Malgré son énorme utilité, lorsque cette loi a été proposée, elle n'a pas eu l'impact ou la pertinence souhaités dans la communauté scientifique..
Cependant, à partir du XXe siècle, il gagnait en notoriété grâce au fait que les scientifiques britanniques William Esson et Vernon Harcourt l'ont repris plusieurs décennies après sa promulgation..
La loi de l'action de masse a eu de nombreuses applications au fil du temps, dont certaines sont énumérées ci-dessous:
- Comme il est formulé en termes d'activités plutôt que de concentrations, il est utile de déterminer les écarts par rapport au comportement idéal des réactifs dans une solution, pour autant qu'il soit compatible avec la thermodynamique..
- Lorsqu'une réaction s'approche de l'équilibre, la relation entre la vitesse nette de la réaction et l'énergie libre instantanée de Gibbs d'une réaction peut être prédite..
- Lorsqu'elle est combinée avec le principe d'équilibre détaillé, en termes généraux, cette loi fournit les valeurs résultantes, selon la thermodynamique, des activités et de la constante à l'état d'équilibre, ainsi que la relation entre celles-ci et les constantes de vitesse résultantes des réactions dans le sens direct. et inverser les directions.
- Lorsque les réactions sont de type élémentaire, en appliquant cette loi on obtient l'équation d'équilibre appropriée pour une certaine réaction chimique et les expressions de sa vitesse.
Exemples de la loi de l'action de masse
-Lors de l'étude d'une réaction irréversible entre des ions trouvés en solution, l'expression générale de cette loi conduit à la formulation de Brönsted-Bjerrum, qui établit la relation entre la force ionique de l'espèce et la constante de vitesse.
-Lors de l'analyse des réactions qui sont effectuées dans des solutions idéales diluées ou dans un état d'agrégation gazeuse, l'expression générale de la loi d'origine (décennie des années 80) est obtenue.
-Comme elle a des caractéristiques universelles, l'expression générale de cette loi peut être utilisée dans le cadre de la cinétique au lieu de la voir comme faisant partie de la thermodynamique.
-Lorsqu'elle est utilisée en électronique, cette loi permet de déterminer que la multiplication entre les densités des trous et les électrons d'une surface donnée a une grandeur constante à l'état d'équilibre, même indépendamment du dopage fourni au matériau..
-L'utilisation de cette loi pour décrire la dynamique entre prédateurs et proies est largement connue, en supposant que la relation de prédation sur la proie présente une certaine proportion avec la relation entre prédateurs et proies..
-Dans le domaine des études de santé, cette loi peut même être appliquée pour décrire certains facteurs du comportement humain, du point de vue politique et social.
La loi de l'action de masse en pharmacologie
En supposant que D est le médicament et R le récepteur sur lequel il agit, tous deux réagissent pour engendrer le complexe DR, qui est responsable de l'effet pharmacologique:
K = [DR] / [D] [R]
K est la constante de dissociation. Il y a une réaction directe dans laquelle le médicament agit sur le récepteur, et une autre où le complexe DR se dissocie en composés d'origine. Chaque réaction a sa propre vitesse, ne s'équilibrant qu'à l'équilibre, satisfaisant K.
En interprétant la loi de masse à la lettre, plus la concentration de D est élevée, plus la concentration du complexe DR formé est élevée..
Cependant, le nombre total de récepteurs Rt a une limite physique, il n'y a donc pas de quantité illimitée de R pour tous les D. disponibles. De même, des études expérimentales dans le domaine de la pharmacologie ont trouvé les limites suivantes à la loi de masse dans ce domaine:
- Il suppose que la liaison R-D est réversible, alors que dans la plupart des cas elle ne l'est vraiment pas..
- La liaison R-D peut modifier structurellement l'un des deux composants (le médicament ou le récepteur), une circonstance qui ne tient pas compte de la loi de masse.
- De plus, la loi de masse pâlit face aux réactions où de multiples intermédiaires interviennent dans la formation de RD..
Limites
La loi de l'action de masse suppose que toute réaction chimique est de type élémentaire; en d'autres termes, que la molécule est la même que l'ordre de réaction respectif pour chaque espèce impliquée.
Ici, les coefficients stoechiométriques a, b, c et d sont considérés comme le nombre de molécules impliquées dans le mécanisme de réaction. Cependant, dans une réaction globale, ceux-ci ne coïncident pas nécessairement avec leur ordre..
Par exemple, pour la réaction aA + bB <=> cC + dD:
Les expressions de vitesse pour les réactions directes et inverses sont:
k1= [A]à[B]b
kdeux= [C]c[RÉ]ré
Ceci ne s'applique qu'aux réactions élémentaires, car pour les réactions globales, bien que les coefficients stœchiométriques soient corrects, ce ne sont pas toujours les ordres de réaction. Dans le cas de la réaction directe, cette dernière pourrait être:
k1= [A]w[B]z
Dans cette expression, w et z seraient les vrais ordres de réaction pour les espèces A et B.
Les références
- Jeffrey Aronson. (2015, 19 novembre). Les lois de la vie: la loi de l'action de masse de Guldberg et Waage. Extrait le 10 mai 2018 de: cebm.net
- ScienceHQ. (2018). Loi de l'action de masse. Extrait le 10 mai 2018 de: sciencehq.com
- askiitans. (2018). Loi de l'action de masse et constante d'équilibre. Récupéré le 10 mai 2018 de: askiitians.com
- Encyclopédie Salvat des Sciences. (1968). Chimie. Volume 9, Salvat S.A. des éditions Pamplona, Espagne. P 13-16.
- Walter J. Moore. (1963). Chimie physique. Dans Thermodynamique et équilibre chimique. (Quatrième éd.). Longmans. P 169.
- Alex Yartsev. (2018). La loi de l'action de masse en pharmacodynamique. Extrait le 10 mai 2018 de: derangedphysiology.com


Personne n'a encore commenté ce post.