
Équation de la loi de Henry, déviation, applications
La loi d'Henry déclare qu'à température constante, la quantité de gaz dissous dans un liquide est directement proportionnelle à sa pression partielle à la surface du liquide.
Il a été postulé en 1803 par le physicien et chimiste anglais William Henry. Sa loi peut également être interprétée de cette manière: si la pression sur le liquide est augmentée, plus la quantité de gaz dissous sera élevée..

Ici, le gaz est considéré comme le soluté de la solution. Contrairement au soluté solide, la température a un effet négatif sur sa solubilité. Ainsi, à mesure que la température augmente, le gaz a tendance à s'échapper plus facilement du liquide vers la surface..
En effet, l'augmentation de la température apporte de l'énergie aux molécules gazeuses, qui se heurtent les unes aux autres pour former des bulles (image du haut). Ces bulles surmontent alors la pression externe et s'échappent du sinus du liquide..
Si la pression externe est très élevée et que le liquide est maintenu froid, les bulles se dissoudront et seules quelques molécules gazeuses «planeront» à la surface.
Index des articles
- 1 Équation de la loi de Henry
- 2 Écart
- 3 Solubilité d'un gaz dans le liquide
- 3.1 Insaturé
- 3.2 saturés
- 3.3 sursaturé
- 4 applications
- 5 exemples
- 6 Références
Équation de la loi de Henry
Il peut être exprimé par l'équation suivante:
P = KH∙ C
Où P est la pression partielle du gaz dissous; C est la concentration de gaz; et KH est la constante de Henry.
Il faut comprendre que la pression partielle d'un gaz est celle qui est individuellement exercée par une espèce du reste du mélange gazeux total. Et la pression totale n'est rien de plus que la somme de toutes les pressions partielles (loi de Dalton):
PLe total= P1 + Pdeux + P3+… + Pn
Le nombre d'espèces gazeuses qui composent le mélange est représenté par n. Par exemple, si à la surface d'un liquide il y a de la vapeur d'eau et du COdeux, n égale 2.
Déviation
Pour les gaz peu solubles dans les liquides, la solution est proche de l'idéal, respectant la loi de Henry pour le soluté.
Cependant, lorsque la pression est élevée, il y a un écart par rapport à Henry, car la solution cesse de se comporter comme un dilué idéal.
Que signifie? Ces interactions soluté-soluté et soluté-solvant commencent à avoir leurs propres effets. Lorsque la solution est très diluée, les molécules de gaz sont «exclusivement» entourées de solvant, négligeant les éventuelles rencontres entre elles..
Par conséquent, lorsque la solution n'est plus idéalement diluée, la perte de comportement linéaire est observée dans le graphe Pje contre Xje.
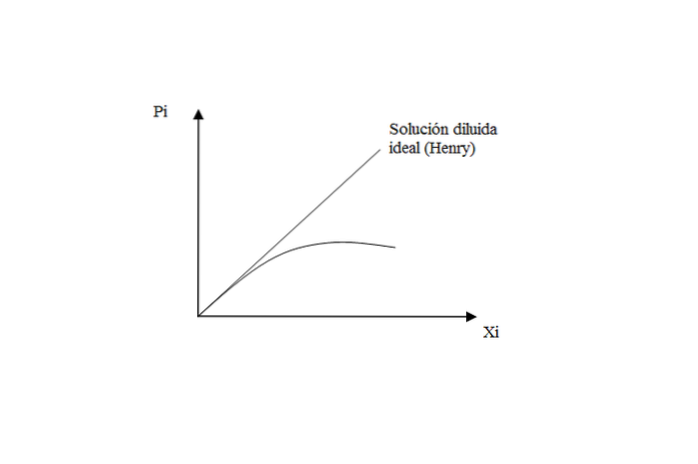
En conclusion à cet aspect: la loi de Henry détermine la pression de vapeur d'un soluté dans une solution diluée idéale. Alors que pour le solvant, la loi de Raoult s'applique:
PÀ = XÀ∙ PÀ*
Solubilité d'un gaz dans le liquide

Lorsqu'un gaz est bien dissous dans un liquide, tel que du sucre dans l'eau, il ne peut pas être distingué de l'environnement, formant ainsi une solution homogène. En d'autres termes: aucune bulle n'est observée dans le liquide (ou cristaux de sucre).
Cependant, la solvatation efficace des molécules gazeuses dépend de certaines variables telles que: la température du liquide, la pression qui l'affecte, et la nature chimique de ces molécules par rapport à celles du liquide..
Si la pression externe est trop élevée, les chances de pénétration de gaz dans la surface du liquide sont augmentées. Et d'autre part, les molécules gazeuses dissoutes ont plus de mal à surmonter la pression incidente pour s'échapper vers l'extérieur..
Si le système liquide-gaz est sous agitation (comme cela se produit dans la mer et dans les pompes à air à l'intérieur de l'aquarium), l'absorption de gaz est favorisée.
Et comment la nature du solvant affecte-t-elle l'absorption d'un gaz? S'il est polaire, comme l'eau, il montrera une affinité pour les solutés polaires, c'est-à-dire pour les gaz qui ont un moment dipolaire permanent. Alors que s'il est apolaire, comme les hydrocarbures ou les graisses, il préférera les molécules gazeuses apolaires
Par exemple, l'ammoniac (NH3) est un gaz très soluble dans l'eau en raison des interactions de liaison hydrogène. Alors que l'hydrogène (Hdeux), dont la petite molécule est apolaire, interagit faiblement avec l'eau.
De plus, en fonction de l'état du processus d'absorption de gaz dans le liquide, les états suivants peuvent y être établis:
Insaturé
Le liquide est insaturé lorsqu'il est capable de dissoudre plus de gaz. En effet, la pression externe est supérieure à la pression interne du liquide..
Saturé
Le liquide établit un équilibre dans la solubilité du gaz, ce qui signifie que le gaz s'échappe à la même vitesse qu'il pénètre dans le liquide..
On peut également le voir de la manière suivante: si trois molécules gazeuses s'échappent dans l'air, trois autres retourneront dans le liquide en même temps.
Sursaturé
Le liquide est sursaturé en gaz lorsque sa pression interne est supérieure à la pression externe. Et, avec un minimum de changement dans le système, il libèrera un excès de gaz dissous jusqu'à ce que l'équilibre soit rétabli.
Applications
- La loi d'Henry peut être appliquée pour faire les calculs d'absorption des gaz inertes (azote, hélium, argon, etc.) dans les différents tissus du corps humain, et cela avec la théorie de Haldane sont la base des tables de décompression.
- Une application importante est la saturation des gaz sanguins. Lorsque le sang n'est pas saturé, le gaz s'y dissout, jusqu'à ce qu'il devienne saturé et cesse de se dissoudre davantage. Une fois que cela se produit, le gaz dissous dans le sang passe dans l'air..
- La gazéification des boissons gazeuses est un exemple de la loi de Henry appliquée. Les boissons gazeuses contiennent du COdeux dissous sous haute pression, maintenant ainsi chacun des composants combinés qui le composent; et en plus, il préserve la saveur caractéristique beaucoup plus longtemps.
Lorsque la bouteille de soda n'est pas bouchée, la pression au-dessus du liquide diminue, libérant la pression instantanément.
Puisque la pression sur le liquide est maintenant plus faible, la solubilité du COdeux descend et s'échappe dans l'environnement (peut être vu dans la montée des bulles par le bas).

- Lorsqu'un plongeur descend à de plus grandes profondeurs, l'azote inhalé ne peut pas s'échapper car la pression externe l'empêche, se dissolvant dans le sang de l'individu.
Lorsque le plongeur remonte rapidement à la surface, où la pression externe baisse à nouveau, l'azote commence à faire des bulles dans le sang..
Cela provoque ce que l'on appelle le mal de décompression. C'est pour cette raison que les plongeurs doivent monter lentement, de sorte que l'azote s'échappe plus lentement du sang..
- Etude des effets de la diminution de l'oxygène moléculaire (Odeux) dissous dans le sang et les tissus des alpinistes ou des pratiquants d'activités qui impliquent un séjour prolongé en haute altitude, ainsi que chez les habitants de lieux assez élevés.
- Recherche et amélioration des méthodes utilisées pour éviter les catastrophes naturelles pouvant être causées par la présence de gaz dissous dans d'immenses plans d'eau pouvant être violemment libérés.
Exemples
La loi de Henry ne s'applique que lorsque les molécules sont en équilibre. Voici quelques exemples:
- Dans l'oxygène dissous (Odeux) dans le liquide sanguin, cette molécule est considérée comme peu soluble dans l'eau, bien que sa solubilité soit considérablement augmentée par la teneur élevée en hémoglobine qu'elle contient. Ainsi, chaque molécule d'hémoglobine peut se lier à quatre molécules d'oxygène qui sont libérées dans les tissus pour être utilisées dans le métabolisme.
- En 1986, un épais nuage de dioxyde de carbone a été enregistré qui a été soudainement expulsé du lac Nyos (situé au Cameroun), étouffant environ 1700 personnes et un grand nombre d'animaux, ce qui a été expliqué par cette loi..
- La solubilité qu'un gaz donné se manifeste dans une espèce liquide a tendance à augmenter à mesure que la pression dudit gaz augmente, bien qu'à des pressions élevées il existe certaines exceptions, telles que les molécules d'azote (Ndeux).
- La loi de Henry n'est pas applicable lorsqu'il y a une réaction chimique entre la substance qui agit comme un soluté et celle qui agit comme un solvant; c'est le cas des électrolytes, comme l'acide chlorhydrique (HCl).
Les références
- Crockford, H.D., Knight Samuel B. (1974). Fondamentaux de la physicochimie. (6e éd.). Editorial C.E.C.S.A., Mexique. P 111-119.
- Les éditeurs de l'Encyclopaedia Britannica. (2018). La loi d'Henry. Extrait le 10 mai 2018 de: britannica.com
- Byju's. (2018). Quelle est la loi de Henry?. Récupéré le 10 mai 2018 de: byjus.com
- Leisurepro et Aquaviews. (2018). Henry's Law Extrait le 10 mai 2018 de: Leisurepro.com
- Fondation Annenberg. (2017). Section 7: Loi de Henry. Extrait le 10 mai 2018 de: Learner.org
- Monica Gonzalez. (25 avril 2011). La loi d'Henry. Récupéré le 10 mai 2018 de: quimica.laguia2000.com
- Ian Myles. (24 juillet 2009). Plongeur. [Chiffre]. Extrait le 10 mai 2018 de: flickr.com



Personne n'a encore commenté ce post.