
Pluies acides, comment elles se forment, composition, réactions et effets

La pluie acide C'est la précipitation humide ou sèche de substances qui génèrent un pH inférieur à 5,6. Ces précipitations peuvent être humides (diluées dans l'eau de pluie) ou sèches (dépôts de particules ou d'aérosols).
Le terme «pluie acide» a été proposé pour la première fois par le chercheur anglais Robert Angus Smith en 1850, au milieu de la révolution industrielle. Les acides les plus abondants qui se forment dans l'atmosphère sont nitriques et sulfuriques par oxydation de polluants naturels ou artificiels..
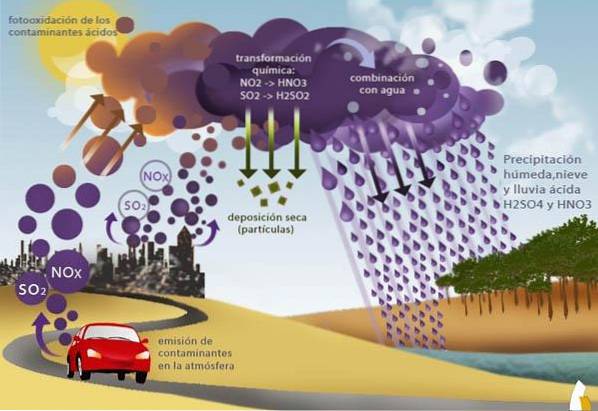
Les polluants les plus importants sont les oxydes: NO2, NO3, SO2, dont les sources naturelles sont les éruptions volcaniques, les incendies de forêt et la dégradation bactérienne. Les sources artificielles sont les émissions de gaz provenant de la combustion de combustibles fossiles (activité industrielle et trafic automobile).
Les pluies acides ont des effets négatifs sur l'environnement tels que l'acidification des sols et des eaux, affectant les êtres vivants, y compris les humains. De même, les sols et l'eau sont contaminés par des métaux lourds et l'eutrophisation se produit dans les plans d'eau..
Au niveau de la végétation, des dommages directs aux feuilles se produisent et la croissance des plantes est affectée. De plus, l'acidification du sol immobilise les nutriments et affecte les mycorhizes (champignons du sol). De même, les bâtiments, machines, monuments et œuvres d'art exposés aux éléments sont sérieusement oxydés ou érodés par l'effet des acides précipités..
Pour remédier à l'effet des pluies acides, certaines mesures essentielles peuvent être prises comme la protection des monuments et la correction de l'acidification des sols et des eaux. Cependant, la solution de base pour les pluies acides est de réduire l'émission dans l'atmosphère de composés chimiques précurseurs de la formation d'acides..
Index des articles
- 1 Comment se forment les pluies acides?
- 1.1 Précurseurs chimiques
- 1.2 Processus troposphérique et acides produits
- 1.3 Précipitations
- 2 Composition
- 3 Réactions chimiques des pluies acides
- 3.1 Formation d'acide sulfurique (H2SO4)
- 3.2 Formation d'acide nitrique (HNO3)
- 4 Effets sur l'environnement
- 4.1 L'acidification des sols et ses effets sur la végétation
- 4.2 Effet sur les aquifères et la santé humaine
- 4.3 Détérioration des bâtiments, monuments et matériaux
- 5 Flore et faune
- 5.1 Plantes et animaux dans les plans d'eau lentiques
- 5.2 Végétation et disponibilité des éléments nutritifs
- 5.3 Dommages directs aux plantes et aux animaux
- 6 solutions
- 6.1 Réduire les émissions
- 6.2 Appliquer des mesures de correction de l'acidité
- 6.3 Protection de surface
- 7 Références
Comment se forment les pluies acides?

Agents précurseurs chimiques
Le phénomène des pluies acides commence par l'émission dans l'atmosphère de composés chimiques précurseurs de la formation d'acides. Ces composés peuvent être émis par des sources naturelles ou artificielles.
Les sources naturelles comprennent les éruptions volcaniques, les incendies de végétation et les émissions océaniques. Comme les sources artificielles agissent sur les émissions industrielles, les émissions des véhicules à moteur à combustion ou la combustion des déchets.
Ces sources émettent divers composés susceptibles de générer des acides dans l'atmosphère. Cependant, les plus importants sont les oxydes d'azote et les oxydes de soufre.
Les oxydes d'azote sont connus sous le nom de NOx et comprennent le dioxyde d'azote (NO2) et l'oxyde nitreux (NO). De son côté, l'oxyde de soufre est du SO2 ou du dioxyde de soufre.
Processus troposphérique et acides produits
Le phénomène des pluies acides se produit dans la troposphère (zone atmosphérique qui va de la surface terrestre à une hauteur de 16 km).
Dans la troposphère, les courants d'air peuvent transporter ces composés sur n'importe quelle partie de la planète, ce qui en fait un problème mondial. Dans ce processus, les oxydes d'azote et de soufre interagissent avec d'autres composés pour former respectivement de l'acide nitrique et de l'acide sulfurique..
Soutien à la réaction
Les réactions chimiques peuvent être effectuées soit sur des particules solides en suspension, soit dans des gouttes d'eau en suspension..
L'acide nitrique se forme principalement en phase gazeuse, en raison de sa faible solubilité dans l'eau. De son côté, l'acide sulfurique est plus soluble dans l'eau, étant le principal constituant des pluies acides.
Acide nitrique
Pour la formation d'acide nitrique (HNO3), les oxydes d'azote réagissent avec l'eau, avec des radicaux tels que OH (dans une moindre mesure avec HO2 et CH3O2), ou avec l'ozone troposphérique (O3).
Acide sulfurique
Dans le cas de la production d'acide sulfurique (H2SO4), les radicaux OH, HO2, CH3O2, l'eau et l'ozone participent également. De plus, il peut être formé en réagissant avec du peroxyde d'hydrogène (H2O2) et divers oxydes métalliques..
Acide carbonique
Le H2CO3 se forme grâce à la réaction photochimique du dioxyde de carbone avec l'eau atmosphérique.
Acide chlorhydrique
Le HCl ne représente que 2% des pluies acides et son précurseur est le chlorure de méthyle (ClCH3). Ce composé provient des océans et est oxydé par les radicaux OH pour former de l'acide chlorhydrique..
Précipitation
Une fois que les composés acides (acide nitrique ou acide sulfurique, et dans une moindre mesure acide chlorhydrique) se sont formés, ils précipiteront.
La précipitation peut se faire par dépôt des particules en suspension dans lesquelles la réaction d'acidification a eu lieu en phase gazeuse. Une autre façon est que sous la pluie, l'eau condensée où les acides se sont formés précipite.
Composition
L'acidité naturelle de la pluie est proche d'un pH de 5,6, bien que dans certaines zones non contaminées des valeurs de 5. Ces faibles valeurs de pH ont été associées à la présence d'acides d'origine naturelle..
On considère qu'en fonction du niveau de pH, la pluie peut être classée en:
a) Légèrement acide (pH entre 4,7 et 5,6)
b) Acide moyen (pH entre 4,3 et 4,7)
c) Fortement acide (pH inférieur ou égal à 4,3).
Si la pluie a une concentration> 1,3 mg / L de nitrates et> 3 mg / L dans le cas des sulfates, la contamination est considérée comme élevée.
Les pluies acides se composent dans plus des deux tiers des cas de la présence d'acide sulfurique, suivi en abondance d'acide nitrique. Les autres composants qui peuvent contribuer à l'acidité de la pluie sont l'acide chlorhydrique et l'acide carbonique..
Réactions chimiques des pluies acides
Formation d'acide sulfurique (H2SO4)
La production d'acide sulfurique peut avoir lieu en phase gazeuse ou en phase liquide.
Phase gazeuse
Seulement 3-4% du SO2 est oxydé en phase gazeuse pour produire de l'acide sulfurique. Il existe de nombreuses voies de formation d'acide sulfurique à partir de précurseurs gazeux, ici la réaction du SO2 avec l'ozone troposphérique est montrée.
La réaction se déroule en deux étapes:
1.- Le dioxyde de soufre réagit avec l'ozone troposphérique générant du trioxyde de soufre et libérant de l'oxygène.
SO2 + O3 = SO3 + O2
2.- Ensuite, le trioxyde de soufre est oxydé avec de la vapeur d'eau et produit de l'acide sulfurique.
SO3 + H2O = H2SO4
Phase liquide
Dans les gouttes d'eau qui formeront la pluie, l'acide sulfurique peut être produit de plusieurs manières:
1.- Le SO2 se dissout dans l'eau générant de l'acide sulfureux, et celui-ci est oxydé par le peroxyde d'hydrogène:
SO2 + H2O = H2SO2
H2SO2 + H2O2 = H2SO4 + H2O
2.- Mécanisme photocatalytique: Dans ce cas, les particules d'oxyde métallique (fer, zinc, titane) sont activées grâce à l'action de la lumière du soleil (activation photochimique) et oxydent le SO2 générant de l'acide sulfurique.
Formation d'acide nitrique (HNO3)
L'ozone troposphérique O3 produit la transformation du NO2 en HNO3 dans un processus en trois étapes:
1.- NO2 + O3 = NO3 + O2
2.- NO3 + NO2 = N2O5
3.- N2O5 + H2O = 2HNO3
Effets sur l'environnement

L'acidification des sols et ses effets sur la végétation
L'effet des pluies acides sur le sol varie en fonction de sa composition. Par exemple, les sols d'origine calcaire, basaltique et ignée ont une plus grande capacité à neutraliser l'acidité..
De leur côté, les sols riches en quartz comme matériau inerte ne sont pas capables de réguler la teneur en acide. Ainsi, dans les sols où les pluies acides augmentent l'acidité, des ions métalliques toxiques pour les plantes et les animaux sont libérés et emportés..
Un cas pertinent est la dissolution des aluminosilicates, qui libèrent des ions aluminium très nocifs pour la végétation..
En général, l'acidité du sol réduit la disponibilité des nutriments pour les plantes. De plus, il favorise la libération et le lavage du calcium, ce qui provoque des carences chez les plantes.
Effet sur les aquifères et la santé humaine
Dans la plupart des cas, les pluies acides n'ont pas un aspect ou un goût différent de la pluie normale et ne génèrent pas non plus de sensations sur la peau. Ses effets sur la santé humaine sont indirects et causent rarement des dommages cutanés dus à une acidité extrême..
L'un des problèmes des pluies acides est qu'en abaissant les valeurs de pH en dessous de 5, les métaux lourds sont libérés et emportés. Ces polluants tels que l'aluminium et le cadmium peuvent pénétrer dans les aquifères souterrains.
Si l'eau de ces aquifères contaminés passe dans des puits utilisés pour la consommation humaine, cela peut causer de graves dommages à la santé..
Détérioration des bâtiments, monuments et matériaux

Pierres de type calcaire
Les constructions, monuments et sculptures en calcaire ou en marbre sont gravement affectés par les pluies acides. C'est assez grave, car de nombreux bâtiments historiques et œuvres d'art sont construits avec ces matériaux..
Dans le cas du calcaire, les pluies acides provoquent la dissolution du calcaire et la recristallisation de la calcite. Cette recristallisation produit des tons blanchâtres en surface..
Dans le cas particulier de la pluie avec de l'acide sulfurique, le phénomène de sulfatation se produit. Grâce à ce processus, la surface de la roche est transformée en gypse et du CO2 est libéré..
Le marbre, bien que plus résistant, est également affecté par les pluies acides. Dans ce cas, l'exfoliation de la pierre se produit, c'est pourquoi les couches superficielles de celle-ci se détachent.
Autres matériaux non corrosifs
Dans certains bâtiments, la détérioration structurelle est mineure, mais aussi avec des effets négatifs. Par exemple, les dépôts d'acide sec rendent les murs sales, augmentant les coûts d'entretien.
Métaux
Les pluies acides provoquent la corrosion des métaux en raison du phénomène d'oxydation. Cela entraîne d'énormes pertes économiques, car les structures, les équipements, les machines et les véhicules comportant des pièces métalliques sont gravement affectés..
Flore et faune

Les pluies acides modifient l'équilibre naturel des écosystèmes aquatiques et terrestres.
Plantes et animaux dans les plans d'eau lentiques
Les plans d'eau lentiques sont plus sensibles à l'acidification, car ce sont des écosystèmes fermés. De plus, l'accumulation d'acides dans l'eau a des conséquences négatives sur la vie qu'elle abrite..
Une autre conséquence de l'acidification est la précipitation des nitrates par la pluie, qui provoque l'eutrophisation des plans d'eau. L'excès de nutriments réduit l'oxygène disponible et affecte négativement la survie des animaux aquatiques.
Un autre effet négatif indirect est l'entraînement d'ions de métaux lourds de l'environnement terrestre dans les plans d'eau. Ces ions sont libérés dans le sol par l'action des ions hydronium lorsque l'acidité augmente..
Végétation et disponibilité des nutriments
Les problèmes les plus graves causés par l'acidification des sols sont l'immobilité des nutriments essentiels et l'augmentation des métaux toxiques..
Par exemple, l'aluminium et le magnésium sont libérés des particules du sol en étant remplacés par de l'hydrogène. L'aluminium affecte la structure et la fonction des racines et réduit l'absorption du calcium indispensable aux plantes.
D'autre part, l'acidification des sols cause des dommages aux mycorhizes (champignons associés aux racines), qui sont essentiels dans la dynamique de la forêt..
Dommages directs aux plantes et aux animaux
L'acide sulfurique cause des dommages directs aux feuilles en dégradant la chlorophylle et en produisant de la chlorose (jaunissement de la feuille). Chez certaines espèces, la croissance et la production de graines viables diminuent.
Les amphibiens (grenouilles et crapauds) sont particulièrement sensibles aux effets de l'acidité de l'eau. Certains dommages sont des blessures directes et une diminution de la défense contre les agents pathogènes (en particulier les champignons cutanés).
Solutions
Réduisez les émissions
L'essentiel pour les pluies acides est de réduire les rejets dans l'environnement de précurseurs chimiques acides. Les plus importants d'entre eux sont les oxydes de soufre et d'azote.
Cependant, cela présente quelques difficultés, car cela implique d'affecter les intérêts économiques et de développement des entreprises et des pays. Par exemple, l'une des principales sources de dioxyde de soufre est la combustion du charbon, qui représente plus de 70% de l'énergie en Chine..
Il existe des alternatives technologiques qui peuvent aider à réduire les émissions. Par exemple, dans l'industrie, les soi-disant «lits fluidisés» incorporent des absorbants (calcaire ou dolomite) qui retiennent le SO2. Dans le cas des véhicules automobiles et des moteurs à combustion en général, les pots catalytiques conformes contribuent également à réduire les émissions de SO2..
D'autre part, certains pays ont mis en œuvre des programmes spécifiques de réduction des pluies acides. Par exemple, les États-Unis ont élaboré le National Acid Precipitation Assessment Program (NAPAP). Parmi certaines des mesures envisagées par le NAPAP figure la mise en œuvre de l'utilisation de carburants à faible teneur en soufre.
Une autre mesure possible est le remplacement du parc par des voitures électriques pour réduire à la fois les pluies acides et le réchauffement climatique. Cependant, bien que la technologie existe pour y parvenir, la pression des industries automobile et pétrolière a retardé les décisions à cet égard. D'autres facteurs qui influencent sont des éléments culturels liés à la vitesse qu'un véhicule est censé atteindre..
Appliquer des mesures de correction d'acidité
Dans certains cas, le pH des sols et des eaux peut être augmenté en ajoutant des alcalis, par exemple en incorporant de grandes quantités de chaux. Cependant, cette pratique n'est pas réalisable dans de très grandes superficies de terres..
Protection de surface
Pierre
Il existe différentes méthodes pour protéger ou au moins réduire la détérioration de la pierre sous l'effet des pluies acides. L'une de ces méthodes consiste à le laver à la vapeur ou à l'eau chaude..
Des agents chimiques tels que l'acide fluorhydrique ou le bifluorure d'ammonium peuvent également être utilisés. Une fois lavée, la pierre peut être scellée en appliquant des produits spéciaux qui obstruent les pores, tels que l'hydroxyde de baryum.
Métal
Les surfaces métalliques corrodées peuvent être protégées par un revêtement avec un métal non corrosif tel que le zinc..
Pour cela, une électrodéposition peut être appliquée, ou la structure métallique à protéger peut être immergée dans le métal de protection à l'état liquide..
Les références
- Espada L et A. Sánchez (1995). Influence des pluies acides sur la corrosion des métaux. pp. 145-171. In: Sastre de Vicente M. (Coord.) Electrochimie et environnement au seuil du XXIe siècle. Université de La Corogne. Service des publications. La Coruña, Espagne.
- García-Ruiz G (2018). Protection des structures de bâtiments en atmosphères corrosives. Projet de fin d'études en ingénierie en technologies industrielles. Université polytechnique de Carthagène. Ecole Technique Supérieure de Génie Industriel. Carthagène, Espagne. 75 p.
- Granados-Sánchez D, GF López-Ríos et MA Hernández-García (2010). Pluies acides et écosystèmes forestiers… Chapingo Magazine Forestry and Environmental Sciences Series 16: 187-206.
- Likens GE, CT Driscoll et DC Buso (1996). Effets à long terme des pluies acides: réponse et rétablissement d'un écosystème forestier. Science, 272; 244-246.
Likens GE et FH Bormann (1974). Les pluies acides: un grave problème environnemental régional. Science, 184: 1176-1179. - Schindler DW (1988). Effets des pluies acides sur les écosystèmes d'eau douce. Science, 239: 149-157.
- Vélez-Upegui JJ, MC Valencia-Giraldo, A Londoño-Carvajal, CM González-Duque, JP Mariscal-Moreno (2010). Pollution atmosphérique et pluies acides. Diagnostic du phénomène dans la ville de Manizales. Faculté d'ingénierie et d'architecture. Université nationale de Colombie. Siège de Manizales. Editorial Blanecolor Ltda, première édition. Manizales, Colombie. 150 p.



Personne n'a encore commenté ce post.