
Masse molaire comment la calculer, exemples et exercices résolus
La masse molaire est une propriété intensive de la matière qui relie le concept de taupe à des mesures de masse. Plus concis, c'est la quantité de masse correspondant à une mole de substance; c'est-à-dire ce qu'un nombre Avogadro «pèse», (6.022 · 102. 3) de particules déterminées.
Une mole de n'importe quelle substance contiendra le même nombre de particules (ions, molécules, atomes, etc.); cependant, sa masse variera parce que ses dimensions moléculaires sont définies par le nombre d'atomes et les isotopes qui composent sa structure. Plus l'atome ou la molécule est massif, plus sa masse molaire est grande..
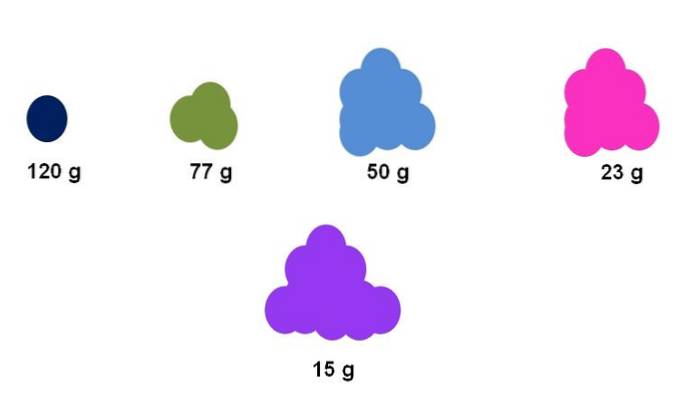
Par exemple, supposons qu'une seule mole soit collectée pour cinq composés différents (image du haut). À l'aide d'une balance, la masse de chaque grappe, exprimée ci-dessous, a été mesurée. Cette masse correspond à la masse molaire. De tous, le composé violet a les particules les plus légères, tandis que le composé bleu foncé a les particules les plus lourdes..
A noter qu'une tendance généralisée et exagérée est affichée: plus la masse molaire est élevée, plus la quantité d'échantillon à placer sur la balance est petite. Cependant, ce volume de matière est également fortement dépendant de l'état d'agrégation de chaque composé et de sa densité..
Index des articles
- 1 Comment calculez-vous la masse molaire?
- 1.1 Définition
- 1.2 Éléments
- 1.3 Composés
- 2 exemples
- 3 exercices résolus
- 3.1 Exercice 1
- 3.2 Exercice 2
- 3.3 Exercice 3
- 4 Références
Comment calculer la masse molaire?

Définition
La masse molaire peut être calculée en fonction de sa définition: quantité de masse par mole de substance:
M = grammes de substance / mole de substance
En fait, g / mol est l'unité dans laquelle la masse molaire est généralement exprimée, avec kg / mol. Ainsi, si nous savons combien de moles nous avons d'un composé ou d'un élément, et que nous le pesons, nous arriverons directement à sa masse molaire en appliquant une division simple.
Éléments
La masse molaire s'applique non seulement aux composés, mais également aux éléments. Le concept de grains de beauté ne fait aucune discrimination. Par conséquent, à l'aide d'un tableau périodique, nous localisons les masses atomiques relatives pour un élément d'intérêt, et nous multiplions sa valeur par 1 g / mol; c'est la constante d'Avogadro, MOU ALORS.
Par exemple, la masse atomique relative du strontium est de 87,62. Si nous voulons avoir sa masse atomique, elle serait de 87,62 amu; mais si ce que nous recherchons est sa masse molaire, alors elle sera de 87,62 g / mol (87,62 · 1g / mol). Et ainsi, les masses molaires de tous les autres éléments sont obtenues de la même manière, sans même avoir à effectuer ladite multiplication..
Composés
La masse molaire d'un composé n'est rien de plus que la somme des masses atomiques relatives de ses atomes multipliée par MOU ALORS.
Par exemple, la molécule d'eau, HdeuxOu, il a trois atomes: deux hydrogène et un oxygène. Les masses atomiques relatives de H et O sont respectivement de 1,008 et 15,999. Ainsi, on additionne leurs masses en multipliant par le nombre d'atomes présents dans la molécule du composé:
2 H (1,008) = 2,016
1 O (15 999) = 15 999
M(HdeuxO) = (2,016 + 15,999) 1g / mol = 18,015 g / mol
C'est une pratique assez courante d'omettre MOU ALORS à la fin:
M(HdeuxO) = (2 016 + 15 999) = 18 015 g / mol
Par masse molaire, on entend des unités de g / mol.
Exemples
L'une des masses molaires les plus connues vient d'être mentionnée: celle de l'eau, 18 g / mol. Ceux qui connaissent ces calculs atteignent un point où ils sont capables de mémoriser certaines masses molaires sans avoir à les chercher ou à les calculer comme cela a été fait ci-dessus. Certaines de ces masses molaires, qui servent d'exemples, sont les suivantes:
-OU ALORSdeux: 32 g / mol
-Ndeux: 28 g / mol
-NH3: 17 g / mol
-CH4: 16 g / mol
-COdeux: 44 g / mol
-HCl: 36,5 g / mol
-HdeuxSW4: 98 g / mol
-CH3COOH: 60 g / mol
-Fe: 56 g / mol
Notez que les valeurs données sont arrondies. Pour des raisons plus précises, les masses molaires doivent être exprimées avec plus de décimales et calculées avec les masses atomiques relatives dues et exactes.
Exercices résolus
Exercice 1
Par des méthodes analytiques, on a estimé qu'une solution d'un échantillon contient 0,0267 mole d'un analyte D. On sait également que sa masse correspond à 14% d'un échantillon dont la masse totale est de 76 grammes. Calculer la masse molaire de l'analyte putatif D.
Nous devons déterminer la masse de D qui est dissoute dans la solution. Nous procédons:
Masse (D) = 76 g 0,14 = 10,64 g D
Autrement dit, nous calculons 14% des 76 grammes de l'échantillon, qui correspondent aux grammes d'analyte D. Ensuite, et enfin, nous appliquons la définition de la masse molaire, car nous avons suffisamment de données pour la calculer:
M(D) = 10,64 g D / 0,0267 mol D
= 398,50 g / mol
Ce qui se traduit par: une taupe (6.022102. 3) des molécules Y a une masse égale à 398,50 grammes. Grâce à cette valeur, nous pouvons savoir combien de Y nous voulons peser sur la balance au cas où nous souhaiterions, par exemple, préparer une solution avec une concentration molaire de 5 · 10-3 M; c'est-à-dire dissoudre 0,1993 gramme de Y dans un litre de solvant:
5 10-3 (mol / L) · (398,50 g / mol) = 0,1993 g Y
Exercice 2
Calculer la masse molaire d'acide citrique sachant que sa formule moléculaire est C6H8OU ALORS7.
La même formule C6H8OU ALORS7 Il facilite la compréhension du calcul, car il nous indique à la fois le nombre d'atomes de C, H et O qui se trouvent dans l'acide citrique. Par conséquent, nous répétons la même étape effectuée pour l'eau:
6 C · (12,0107) = 72,0642
8 H (1 008) = 8 064
7 O (15 999) = 111 993
M(acide citrique) = 72,0642 + 8,064 + 111,993
= 192,1212 g / mol
Exercice 3
Calculer la masse molaire de sulfate de cuivre pentahydraté, CuSO45HdeuxOU ALORS.
Nous savons d'avant que la masse molaire d'eau est de 18,015 g / mol. Cela nous aide à simplifier les calculs, puisque nous l'omettons pour le moment et nous nous concentrons sur le sel anhydre CuSO4.
Nous avons que les masses atomiques relatives du cuivre et du soufre sont respectivement de 63,546 et 32,065. Avec ces données, nous procédons de la même manière que pour l'exercice 2:
1 Cu (63 546) = 63 546
1 S (32 065) = 32 065
4 O (15 999) = 63 996
M(CuSO4) = 63 546 + 32065 + 63 996
= 159,607 g / mol
Mais nous nous intéressons à la masse molaire du sel pentahydraté, pas au sel anhydre. Pour ce faire, il faut ajouter la masse d'eau correspondante au résultat:
5 heuresdeuxO = 5 (18 015) = 90 075
M(CuSO45HdeuxO) = 159,607 + 90,075
= 249,682 g / mol
Les références
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Wikipédia. (2020). Masse molaire. Récupéré de: en.wikipedia.org
- Nissa Garcia. (2020). Qu'est-ce que la masse molaire? Définition, formule et exemples. Étude. Récupéré de: study.com
- Dr Kristy M. Bailey. (s.f.). Tutoriel de stoechiométrie
Recherche de la masse molaire. Récupéré de: occc.edu - Helmenstine, Anne Marie, Ph.D. (02 décembre 2019). Problème d'exemple de masse molaire. Récupéré de: thinkco.com



Personne n'a encore commenté ce post.