
Fondations, préparation et utilisations du support SIM
le moitié SIM est une gélose semi-solide et différentielle, spécialement conçue pour aider à identifier certaines bactéries, principalement de la famille des Enterobacteriaceae. Il est composé de triptein, peptone, sulfate de fer, sulfate d'ammonium, thiosulfate de sodium et agar..
Ce milieu permet la réalisation de trois tests importants: la production de sulfure d'hydrogène (HdeuxS), formation d'indole et motilité, d'où l'acronyme SIM vient. En raison de sa grande utilité, il ne peut pas manquer dans un laboratoire de bactériologie.

Contrairement à d'autres milieux, il doit être semi-solide pour que la capacité de mouvement de certaines bactéries soit détectable. En ce sens, ce test fonctionne très bien pour les entérobactéries, mais pas pour les bâtonnets Gram négatifs non fermentants, où il est préférable d'utiliser d'autres méthodes, telles que la goutte suspendue..
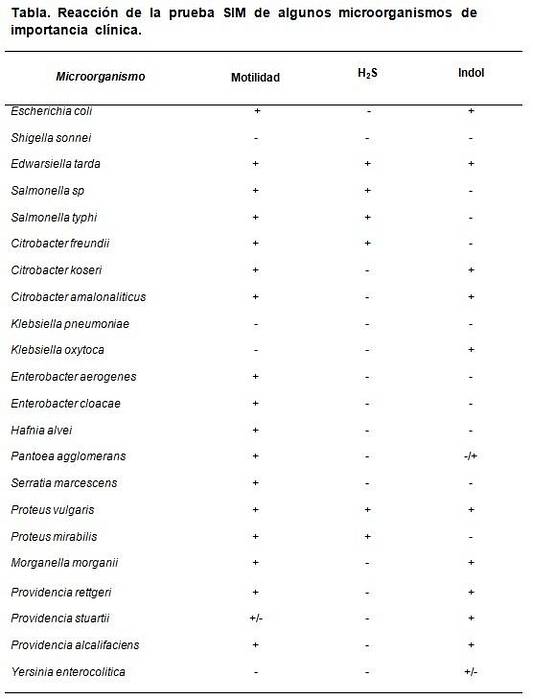
Le support SIM permet de distinguer certaines propriétés spécifiques qui caractérisent certaines bactéries par rapport à d'autres. Par exemple Escherichia coli se distingue en étant HdeuxS (-), Indole (+) et motilité (+), tandis que Proteus mirabilis c'est HdeuxS (+), indole (-), motilité (+).
Index des articles
- 1 Justification
- 1.1 Source d'alimentation
- 1.2 Production de sulfure d'hydrogène
- 1.3 Formation d'indole
- 1.4 Motilité
- 2 Préparation
- 2.1 SIM moyenne
- 2.2 Réactif de Kovac
- 2.3 Réactif d'Erlich
- 3 utilisations
- 3.1 Semis
- 4 Contrôle qualité
- 5 Limitations
- 6 Références
Base
C'est un milieu de culture considéré comme différentiel, car son utilisation distingue les microorganismes capables de produire du sulfure d'hydrogène de ceux qui ne le font pas; Il met également en évidence ceux qui forment l'indole à partir du tryptophane de ceux qui ne le forment pas, et différencie finalement les bactéries mobiles des bactéries immobiles..
Source d'énergie
Comme tout milieu de culture, il contient des éléments qui fournissent les nutriments nécessaires pour que des micro-organismes non exigeants puissent se développer. Ces éléments sont représentés par des peptones et de la triptein.
Le développement du microorganisme dans le milieu est essentiel pour pouvoir observer la présence ou l'absence des caractéristiques que ce milieu évalue..
Production de sulfure d'hydrogène
La lettre S de l'acronyme SIM fait référence à la production de sulfure d'hydrogène (HdeuxS). Les bactéries capables de former du sulfure d'hydrogène absorberont le soufre du thiosulfate de sodium.
Une fois le HdeuxS-gaz incolore-, celui-ci réagit avec le sel de fer présent dans le milieu, formant du sulfure ferreux, bien visible (précipité noir). Les bactéries qui ne forment pas HdeuxOui, laissez le milieu de la couleur d'origine (beige).
La présence du précipité noir peut gêner l'interprétation de la motilité. Cependant, on sait que la plupart des entérobactéries productrices de HdeuxS sont une motilité positive, comme Salmonella, Proteus et Citrobacter. De plus, le précipité noir qui recouvre presque tout le milieu, suggère une motilité positive.
Formation d'indole
La deuxième lettre de l'acronyme SIM est "I", qui représente la formation de l'indole.
En ce sens, la triptein, en plus d'être une source de nutriments, remplit une autre fonction fondamentale. Cette peptone est riche en un acide aminé appelé tryptophane, par conséquent, elle peut montrer les bactéries qui produisent la tryptophanase.
Cette enzyme est responsable du clivage de l'acide aminé tryptophane, avec la formation conséquente d'indole (substance incolore), d'acide pyruvique et d'ammonium.
C'est pourquoi, pour mettre en évidence cette réaction, il est nécessaire d'ajouter une substance révélatrice (réactif d'Ehrlich ou réactif de Kovac). L'un ou l'autre réagit avec l'indole, formant une substance en forme d'anneau rouge-fuchsia à la surface de la gélose. Si l'anneau fuchsia apparaît, le test indole est interprété comme positif.
Les bactéries qui ne possèdent pas cette enzyme ne formeront pas l'anneau et cela est interprété comme un test d'indole négatif.
Il est important de noter que le test à l'indole doit être le dernier à être interprété, car une fois le réactif ajouté, le milieu devient trouble, ce qui rend difficile la visualisation de la motilité..
La motilité
Enfin la lettre "M" du mot SIM signifie motilité. Afin de pouvoir évaluer la motilité, ce milieu est stratégiquement semi-solide, car cette caractéristique est essentielle pour pouvoir observer s'il y a ou non mouvement bactérien. Les bactéries qui ont des flagelles sont celles qui donnent ce test positif.
Un test positif sera évident lorsque la turbidité est observée, à la fois dans l'inoculum initial et autour de celui-ci. Alors que les bactéries non mobiles ne se développent que sur le chemin de l'inoculum initial.
préparation
SIM moyenne
Peser 30 g de milieu déshydraté et dissoudre dans un litre d'eau distillée. Le mélange est laissé au repos pendant 5 minutes puis porté à ébullition en remuant fréquemment jusqu'à dissolution complète..
Répartir le mélange dans des tubes à essai avec des bouchons en coton et autoclave à 121 ° C pendant 15 minutes. Retirer le porte-tubes de l'autoclave et laisser se solidifier en position verticale, de sorte que le milieu ait la forme d'un bloc.
Pour sa conservation, il est conservé au réfrigérateur jusqu'à son utilisation. Le milieu préparé doit avoir un pH final de 7,3 ± 0,2.
Au moment de l'inoculation du milieu, celui-ci doit être à température ambiante. La couleur du milieu est beige.
Réactif de Kovac
Mesurez 150 ml d'alcool amylique, isoamylique ou butylique. (Utilisez l'un des trois mentionnés).
Dissolvez 10 g de p-diméthylaminobenzaldéhyde. Puis ajoutez lentement 50 ml d'acide chlorhydrique concentré.
Le réactif prêt à l'emploi est incolore ou jaune clair. Il doit être conservé dans une bouteille ambrée et conservé au réfrigérateur. Ne pas utiliser s'il prend une couleur brun foncé; cela indique qu'il est endommagé. Ce réactif est préféré pour les entérobactéries.
Réactif d'Erlich
Peser 2 g de p-diméthylaminobenzaldéhyde et dissoudre dans 190 ml d'alcool éthylique absolu et mélanger lentement avec 40 ml d'acide chlorhydrique concentré. Conservez le réactif Kovac de la même manière. Le réactif d'Ehrlich est davantage utilisé pour les bactéries non fermentantes et anaérobies.
Applications
Le milieu SIM est très utilisé dans les laboratoires de bactériologie. Il présente l'avantage que trois caractéristiques essentielles dans l'identification des entérobactéries peuvent être observées dans le même tube..
Semé
La bonne façon de semer ce milieu est d'utiliser l'aiguille, avec laquelle une partie de la colonie pure à étudier est prélevée et insérée verticalement au centre du milieu. Une seule fente doit être effectuée. La crevaison ne doit pas atteindre le fond du tube, la bonne chose est de ne couvrir que les deux tiers de la profondeur.
Il n'est pas recommandé de répéter l'inoculum, car cela peut conduire à de fausses interprétations de la motilité positive. Le milieu inoculé est incubé en aérobiose à 37 ° C pendant 24 heures..
Après le temps, on observe s'il y a eu ou non production de HdeuxS et la motilité sont lus. Enfin, l'indole est révélé, en ajoutant 3 à 4 gouttes de réactif d'Ehrlich ou de Kovac, mélanger doucement et interpréter.
Contrôle de qualité
A titre de contrôle de stérilité, un ou deux tubes sont incubés sans ensemencement dans une étuve à 37 ° C pendant 24 heures. Il est prévu qu'après cette période, il n'y aura pas de croissance ou de changement de couleur.
Comme contrôle qualité, des souches connues certifiées peuvent être utilisées, telles que: Escherichia coli ATCC 25922, Enterobacter aerogenes ATCC 13048, Klebsiella pneumoniae ATCC 13883, Salmonella typhimurium ATCC 14028, Shigella sonnei ATCC 29930, Proteus vulgaris ATCC 13315.
Les résultats attendus sont: Escherichia coli HdeuxMotilité S négative, indole et positive, Enterobacter aerogenes seulement une motilité positive, Salmonella typhimurium HdeuxS et motilité positive, avec indole négatif. Proteus vulgaris tout positif, tandis que Klebsiella pneumoniae Oui Shigella sonnei tout négatif.
Limites
-Certaines souches de Morganella morganii, Entre autres souches, elles peuvent produire un pigment brunâtre dans ce milieu du fait de la production de mélanine, cela ne doit pas être confondu avec le précipité de sulfure ferreux. Chez les professionnels inexpérimentés, cette situation peut générer des faux positifs dans l'interprétation du test H.deuxS.
-Les bactéries aérobies strictes ne se développeront qu'à la surface du tube, ce qui rend difficile l'interprétation de la motilité.
Les références
- Laboratoires BD. BBL SIM Medium. 2008. Disponible sur: bd.com
- Laboratoires Neogen. Moyen SIM. Disponible à: foodsafety
- Difco Francisco Soria Melguizo. Moyen SIM. 2009. Disponible sur: http://f-soria.es
- Laboratoire Brizuela-Lab. SIM moyenne. Disponible sur: .brizuela-lab.com
- Laboratoires Britannia. SIM moyenne. 2015. Disponible sur: studyres.es/doc
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnostic microbiologique. 5e éd. Éditorial Panamericana S.A. Argentine.



Personne n'a encore commenté ce post.