
Caractéristiques, propriétés et utilisations des métalloïdes
Les métalloïdes ou les semi-métaux sont un groupe d'éléments chimiques avec des propriétés physiques et chimiques intermédiaires entre les métaux et les non-métaux. La plupart des chercheurs en chimie acceptent les éléments chimiques suivants comme métalloïdes: bore, silicium, arsenic, germanium, antimoine et tellure (vert dans l'image ci-dessous).
Cependant, un petit groupe de chercheurs ajoute du polonium, de l'astate (de couleur bleue) et du sélénium (de couleur rose) aux métalloïdes..
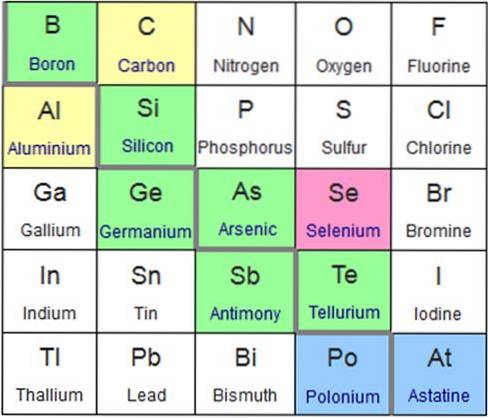
Même sur la base de certaines propriétés, ils suggèrent que les éléments chimiques carbone et aluminium (de couleur jaune) devraient également être considérés comme des métalloïdes..
Index des articles
- 1 Principales caractéristiques des métalloïdes
- 1.1 Situation dans le tableau périodique
- 1.2 Ils forment des alliages avec des métaux
- 1.3 Semi-conducteurs électriques
- 1.4 Fondements de l'industrie électronique
- 1.5 États allotropes
- 2 Propriétés physiques et chimiques
- 2.1 Propriétés physiques
- 2.2 Propriétés chimiques
- 3 utilisations
- 3.1 À propos des êtres vivants
- 3.2 Dans les verres et les émaux
- 3.3 Dans la production de matériaux de meilleure qualité
- 3.4 En électronique et en informatique
- 3.5 Action protectrice des métalloïdes
- 3.6 Autres
- 4 Les 8 éléments métalloïdes
- 5 Références
Principales caractéristiques des métalloïdes
Situation sur le tableau périodique
Les métalloïdes sont situés sur le tableau périodique sur une diagonale descendante entre les colonnes 13, 14, 15, 16 et 17, en commençant par le bore en haut à gauche et en se terminant par l'astate en bas à droite..
Les métaux sont à gauche des métalloïdes et les non-métaux à leur droite; par conséquent, ils représentent la frontière entre les deux types de matière.
Ils forment des alliages avec des métaux
Les métalloïdes forment des alliages avec les métaux et réagissent avec les non-métaux, par exemple avec l'oxygène, le soufre et les halogènes..
Semi-conducteurs électriques
Pour la plupart, ils sont considérés comme des semi-conducteurs électriques, leur conductance étant fonction de la température. À basses températures, la conductance électrique est faible, ils agissent donc comme des isolants électriques, mais à mesure qu'ils chauffent, leur capacité à conduire l'électricité augmente..
Base de l'industrie électronique
Les semi-conducteurs sont à la base du développement de l'industrie électronique, ainsi que de celui de l'informatique et de l'informatique. De même, l'application qui a été faite de silicium a été très utile dans ce domaine.
États allotropes
Les métalloïdes ont différents états allotropes (différentes formes cristallines); ainsi, par exemple, l'arsenic a des cristaux noirs, jaunes ou gris.
Dans la nature, ils ne se trouvent généralement pas sous forme d'éléments chimiques purs, mais plutôt associés ou formant des agrégats dans des minéraux avec le plomb, le soufre, le fer, etc..
Proprietes physiques et chimiques

Propriétés physiques
Ils apparaissent comme des solides brillants. À cet égard, ils ressemblent aux métaux. Ils sont cassants et peu élastiques, ils ne peuvent donc pas être étirés sous la forme d'un fil, c'est-à-dire qu'ils ne sont pas très ductiles. De plus, sa transformation en feuilles est difficile, de sorte que les métalloïdes ne sont pas très malléables..
Ils sont capables de conduire l'électricité et la température, bien qu'à un degré moindre que les métaux. Dans les métalloïdes, il y a des éléments chimiques qui, en fonction de leurs structures de bande, sont classés comme semi-conducteurs.
Ce groupe est composé de bore, de silicium, de germanium et d'antimoine. L'arsenic et le tellure sont classés comme des semi-métaux.
Points de fusion
Bore 2 076 ° C; Silicium 1 414 ° C; Germanium 938,25 ° C; Arsenic 817 ° C; Antimoine 630,13 ° C; Tellure 449,51 ° C et Polonium 254 ° C.
Points d'ébullition
Bore 3 927 ° C; Silicium 3 265 ° C; Germanium 2 833 ° C; Arsenic 614 ° C; Antimoine 1 587 ° C; Tellure 988 ° C et Polonium 962 ° C.
Les densités
Bore 2,34 g / cm3: Silicium 2,33 g / cm3; Germanium 5,323 g / cm3; Arsenic 5 727; Antimoine 6,697 g / cm3; Tellure 6,24 g / cm3 et Polonium 9,32 g / cm3.
Propriétés chimiques
Ils se comportent de la même manière que les non-métaux, ils forment des oxacides comme SiOdeux et ils ont un comportement amphotère. Les métalloïdes peuvent se comporter comme un acide ou une base selon le pH du milieu..
Applications
À propos des êtres vivants
-L'arsenic est utilisé en agriculture comme insecticide et herbicide. De plus, il est utilisé pour le placer sous forme de poudre ou de solution liquide sur le bétail pour éliminer les insectes et parasites de l'animal. L'arséniate de calcium est utilisé pour tuer le charançon de la capsule du coton.
-L'arsenic est utilisé comme agent de préservation du bois en raison de sa toxicité pour les insectes et les champignons.
-L'arsenic est utilisé pour traiter la leucémie aiguë promyélocytaire, un type de cancer du sang. Il est utilisé dans la préparation de la solution de Fowler pour une utilisation dans le traitement du psoriasis. Un isotope radioactif de l'arsenic (74As) est utilisé dans la localisation des tumeurs cancéreuses présentes dans le corps humain.
-L'arsenic fait partie du Melarsoprol, un médicament utilisé dans le traitement de la trypanosomiase humaine africaine. Maladie parasitaire transmise par la mouche tsé-tsé.
-L'oxyde de tellure a été utilisé dans le traitement de la dermatite séborrhéique. De même, d'autres composés de tellure sont utilisés comme agents antimicrobiens..
-Le bore, sous forme d'acide borique, est utilisé comme antiseptique doux dans les yeux, le nez et la gorge.
Dans les verres et les émaux
-Le tellure est utilisé dans la production de verres bleus, bruns et rouges. Le métalloïde peut être déposé électrolytiquement sur l'argent, produisant une finition noirâtre.
-L'antimoine est utilisé pour donner aux verres et aux émaux une teinte jaune. Le bore est utilisé dans la production de verre et de céramique. En particulier, le verre borosilicaté est résistant aux changements de température, c'est pourquoi il est utilisé dans les laboratoires dans les réactions chimiques et les distillations..
-À la maison, les aliments peuvent être cuits en utilisant du verre borosilicaté, sans casser les ustensiles utilisés..
-Le silicium est la principale base de l'industrie du verre, impliqué dans la fabrication de presque tous les objets en verre.
-L'oxyde de germanium est utilisé dans la fabrication d'objectifs de caméra et d'objectifs de microscope. De plus, il est utilisé dans la fabrication du coeur de fibres optiques pour de nombreuses applications..
Dans la production de matériaux de meilleure qualité
-L'arsenic forme des alliages avec le plomb, provoquant une diminution de son point de fusion. Cela entraîne une dureté plus élevée de l'alliage utilisé dans la production de grenaille.
-L'ajout d'une quantité de tellure comprise entre 0,1% et 0,6% d'un alliage plombé augmente sa résistance à la corrosion et à la traction avec une augmentation de la flexibilité. Le tellure est souvent ajouté à la fonte pour durcir la couche superficielle des pièces trempées..
-L'antimoine est utilisé dans les alliages pour produire des roulements, des plaques d'accumulateur et du matériel d'impression.
-Le silicium est utilisé dans la production d'alliages avec une résistance plus élevée aux acides. Tel est le cas de Duriron, qui contient 14% de silicium.
L'alliage de silicium, de fer et d'aluminium est utilisé pour l'élaboration de pièces de grande dureté, qui sont utilisées dans l'industrie automobile.
-L'arsenic forme des alliages avec le platine et le cuivre pour augmenter sa résistance à la corrosion. De plus, de l'arsenic est ajouté à l'alpha-laiton pour augmenter la résistance du zinc. Ce type de laiton est utilisé dans la fabrication de matériaux accessoires pour la plomberie.
En électronique et informatique
-Les métalloïdes sont utilisés comme semi-conducteurs dans l'industrie électronique et informatique. En ce sens, le silicium est le leader du commerce des semi-conducteurs qui forme la base de l'électronique et de l'informatique modernes. Le silicium et ses dérivés sont utilisés dans les ordinateurs, les transiteurs, les cellules solaires et les écrans LCD..
-Tellurium est un semi-conducteur qui a des applications dans l'électroptique et l'électronique.
-Le germanium est un métalloïde semi-conducteur qui est utilisé en conjonction avec le silicium dans les circuits intégrés à grande vitesse pour améliorer leurs performances. Bien que le germanium ait quelque peu déplacé le silicium dans sa fonction de semi-conducteur, son utilisation dans la fabrication de puces miniaturisées a été améliorée..
-Le germanium est utilisé dans la fabrication de panneaux solaires. Même les robots d'exploration sur la planète Mars contiennent du germanium dans leurs cellules solaires. De plus, le germanium est utilisé dans la fabrication de radars.
Action protectrice des métalloïdes
Le bore et ses composés apparentés confèrent une grande résistance aux matériaux dont il fait partie. Cela permet son utilisation dans la création de structures spatiales. De plus, ils sont utilisés dans la production de clubs de golf et de cannes à pêche..
L'action protectrice du carbure de bore est utilisée comme barrières de contrôle dans les réacteurs nucléaires, limitant les fuites de matières radioactives. De plus, le carbure de bore est utilisé dans les gilets pare-balles et dans l'armure des chars de guerre..
Le dioxyde de silicium et la silice, sous forme d'argile ou de sable, sont des composants importants des briques, du béton et du ciment, utilisés dans différentes formes de construction.
Autres
-Le sulfure d'antimoine est utilisé dans les feux d'artifice et les lampes flash d'appareil photo.
-Le bore fait partie des aimants en néodyme.
-Le silicone, un polymère dérivé du silicium, est utilisé dans la fabrication d'huiles et de cires, d'implants mammaires, de lentilles de contact, d'explosifs et dans la pyrotechnie.
-Le germanium est utilisé dans la fabrication de lampes fluorescentes et de certaines LED. De plus, le germanium est utilisé dans les guitares électriques pour produire un son de distorsion caractéristique..
-Le germanium est utilisé dans les applications d'imagerie thermique à des fins militaires et de lutte contre les incendies.
-L'antimoine est utilisé dans la fabrication d'allumettes et de grenades traceurs et localisateurs, ainsi que dans les amorces pour cartouches.
-Le borate de sodium est utilisé comme ignifuge dans les plastiques et les caoutchoucs.
Les 8 éléments métalloïdes
Ce groupe d'éléments chimiques est composé de bore, de silicium, d'antimoine, de tellure, de germanium, d'arsenic, de polonium et d'astate. Cependant, le plus grand nombre de chercheurs dans le domaine de la chimie excluent le polonium et l'astate en tant que métalloïdes..
Par conséquent, le groupe de métalloïdes le plus largement accepté serait constitué du bore, du silicium, de l'antimoine, du tellure, du germanium et de l'arsenic..
Le polonium a été noté comme étant distinctement métallique, puisque ses deux formes allotropes sont des conducteurs métalliques. D'autre part, l'astatine a été classée en 2013 comme un métal, bien qu'auparavant en 1950, elle ait été désignée comme un halogène, un non-métal réactif..
La frontière entre les groupes d'éléments considérés comme des métaux, des métalloïdes ou des non-métaux n'est pas claire. Pour cette raison, certains chercheurs, sur la base d'une propriété, suggèrent que tel ou tel élément devrait être considéré comme métalloïde. Il a été souligné, par exemple, que le carbone, l'aluminium ou le sélénium devraient être classés comme métalloïdes.
Une tentative a été faite pour établir des critères de sélection permettant de classer un élément chimique en métal, métalloïde ou non métallique. D'autres critères de sélection comprennent l'énergie d'ionisation, l'électronégativité et l'efficacité de conditionnement des différents éléments chimiques..
Les références
- Eden Francis. (2002). Classification des éléments. Tiré de: dl.clackamas.edu
- Métaux, métalloïdes et non-métaux. Tiré de: angelo.edu
- Éléments. Métalloïdes. Tiré de: elements.org.es
- Exemple de. (2013). Métalloïdes. Tiré de: examplede.com
- Wikipédia. (2018). Métalloïde. Tiré de: en.wikipedia.org
- Chimie rapide rapide. (2011). Métalloïdes (semi-métalliques). Tiré de: chemistry.patent-invent.com
- Les rédacteurs de l'Encyclopaedia Britannica. (2016, 18 octobre). Métalloïde. Tiré de: britannica.com



Personne n'a encore commenté ce post.