
Groupe méthyle ou méthyle
le groupe méthyle ou méthyle est un substituant alkyle dont la formule chimique est CH3. C'est le plus simple de tous les substituants de carbone en chimie organique, il a un seul carbone et trois hydrogènes; dérive du gaz méthane. Parce qu'il ne peut se lier qu'à un autre carbone, sa position indique la fin d'une chaîne, sa terminaison.
Dans l'image ci-dessous, il y a l'une des nombreuses représentations de ce groupe. Les courbes à sa droite indiquent que derrière le lien H3C- peut être n'importe quel atome ou substituant; un alkyle, R, aromatique ou aryle, Ar, ou un hétéroatome ou un groupe fonctionnel, tel que OH ou Cl.

Lorsque le groupe fonctionnel attaché au méthyle est OH, nous avons l'alcool méthanol, CH3OH; et si c'est Cl, alors nous aurons du chlorure de méthyle, CH3Cl.Dans la nomenclature organique, il est simplement appelé `` méthyle '' précédé du numéro de sa position dans la chaîne carbonée la plus longue.
Le groupe méthyle CH3 est facile à identifier lors des élucidations de structures organiques, notamment grâce à la spectroscopie par résonance magnétique nucléaire au carbone 13 (RMN C13). À partir de celui-ci, après de fortes oxydations, des groupes acides COOH sont obtenus, étant une voie de synthèse pour synthétiser les acides carboxyliques.
Index des articles
- 1 Représentations
- 2 Structure
- 3 propriétés
- 4 Réactivité
- 4.1 Oxydations
- 4.2 Ions
- 4.3 Réaction de méthylation
- 5 Références
Représentations
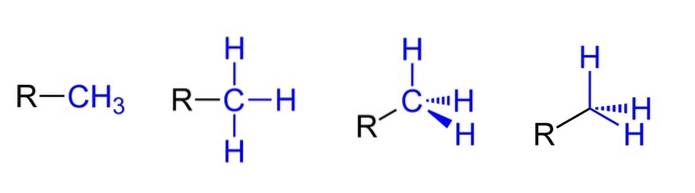
Ci-dessus, nous avons les quatre représentations possibles en supposant que le CH3 est lié à un substituant alkyle R. Tous sont équivalents, mais en allant de gauche à droite les aspects spatiaux de la molécule sont évidents.
Par exemple, R-CH3 cela donne l'impression qu'il est plat et linéaire. La représentation qui suit montre les trois liaisons covalentes C-H, qui permettent d'identifier le méthyle dans n'importe quelle structure de Lewis et donnent la fausse impression d'être un croisement..
Puis, en continuant vers la droite (l'avant-dernière), l'hybridation sp est observée3 sur le carbone de CH3 en raison de sa géométrie tétraédrique. Dans la dernière représentation, le symbole chimique du carbone n'est même pas écrit, mais le tétraèdre est conservé pour indiquer quels atomes H sont devant ou derrière le plan..
Bien que ce ne soit pas dans l'image, une autre manière très récurrente de représenter le CH3 il consiste simplement à placer le trait d'union (-) «nu». Ceci est très utile pour dessiner de grands squelettes en carbone..
Structure

L'image du haut est la représentation tridimensionnelle de la première. La sphère noire brillante correspond à l'atome de carbone, tandis que les blanches sont les atomes d'hydrogène.
Encore une fois, le carbone a un environnement tétraédrique produit de son hybridation sp3, et en tant que tel, c'est un groupe relativement volumineux, avec ses rotations de liaison C-R stériquement empêchées; c'est-à-dire qu'il ne peut pas tourner car les sphères blanches interféreraient avec les nuages électroniques de leurs atomes voisins et ressentiraient leur répulsion.
Cependant, les liaisons C-H peuvent vibrer, tout comme la liaison C-R. Par conséquent, le CH3 est un groupe de géométrie tétraédrique qui peut être élucidé (déterminé, vérifié) par spectroscopie à rayonnement infrarouge (IR), comme tous les groupes fonctionnels et les liaisons carbone avec des hétéroatomes.
La chose la plus importante, cependant, est son élucidation par C-RMN.13. Grâce à cette technique, la quantité relative de groupes méthyle est déterminée, ce qui permet d'assembler la structure moléculaire..
Généralement, plus il y a de groupes CH3 avoir une molécule, plus ses interactions intermoléculaires seront «maladroites» ou inefficaces; c'est-à-dire que plus leurs points de fusion et d'ébullition seront bas. Groupes CH3, en raison de leurs hydrogènes, ils «glissent» les uns contre les autres lorsqu'ils s'approchent ou se touchent.
Propriétés
Le groupe méthyle est caractérisé en ce qu'il est essentiellement hydrophobe et apolaire.
En effet, leurs liaisons C-H ne sont pas très polaires en raison de la faible différence entre les électronégativités du carbone et de l'hydrogène; De plus, sa géométrie tétraédrique et symétrique répartit ses densités d'électrons de manière quasi homogène, ce qui contribue à un moment dipolaire négligeable..
En l'absence de polarité, le CH3 Il «fuit» l'eau, se comportant comme un hydrophobe. Par conséquent, si on le voit dans une molécule, on sait que cette extrémité méthyle n'interagira pas efficacement avec l'eau ou un autre solvant polaire..
Une autre caractéristique du CH3 est sa stabilité relative. À moins que l'atome qui lui est lié ne supprime sa densité électronique, il reste pratiquement inerte vis-à-vis des milieux acides très forts. Cependant, on verra qu'il peut participer à des réactions chimiques, principalement en ce qui concerne son oxydation, ou sa migration (méthylation) vers une autre molécule.
Réactivité
Les oxydations
Le CH3 il n'est pas exempt de rouille. Cela signifie qu'il est susceptible de former des liaisons avec l'oxygène, C-O, s'il réagit avec des agents oxydants puissants. En s'oxydant, il se transforme en différents groupes fonctionnels.
Par exemple, sa première oxydation donne naissance au groupement méthiol (ou hydroxyméthyl), CHdeuxOH, un alcool. Le second dérive dans le groupe formyle, CHO (HC = O), un aldéhyde. Et le troisième, enfin, permet sa conversion en groupe carboxyle, COOH, un acide carboxylique.
Cette série d'oxydations est utilisée pour synthétiser l'acide benzoïque (HOOC-C6H5) du toluène (H3DC6H5).
Ion
Le CH3 pendant le mécanisme de certaines réactions, il peut gagner des charges électriques momentanées. Par exemple, lorsque le méthanol est chauffé en milieu acide très fort, en l'absence théorique de nucléophiles (chercheurs de charges positives), le cation méthyle, CH3+, puisque le lien CH est rompu3-OH et l'OH part avec la paire d'électrons de la liaison.
L'espèce CH3+ il est si réactif qu'il n'a été déterminé qu'en phase gazeuse, car il réagit ou disparaît à la moindre présence d'un nucléophile.
D'autre part, le CH3 on peut également obtenir un anion: méthanide, CH3-, le carbanion le plus simple de tous. Cependant, comme le ch3+, sa présence est anormale et ne se produit que dans des conditions extrêmes.
Réaction de méthylation
Dans la réaction de méthylation, un CH est transféré3 à une molécule sans produire de charges électriques (CH3+ ni CH3-) Dans le processus. Par exemple, l'iodure de méthyle, CH3I, est un bon agent de méthylation, et peut remplacer la liaison O-H de plusieurs molécules par un O-CH3.
En synthèse organique, cela n'entraîne aucune tragédie; mais oui quand ce qui est méthylé en excès, ce sont les bases azotées de l'ADN.
Les références
- Morrison, R. T. et Boyd, R, N. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Interamericana.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (10e édition.). Wiley plus.
- Rahul Gladwin. (23 novembre 2018). Méthylation. Encyclopædia Britannica. Récupéré de: britannica.com
- Danielle Reid. (2019). Groupe méthyle: structure et formule. Étude. Récupéré de: study.com
- Wikipédia. (2019). Groupe méthyle. Récupéré de: en.wikipedia.org


Personne n'a encore commenté ce post.