
Structure, fonction et formation des micelles
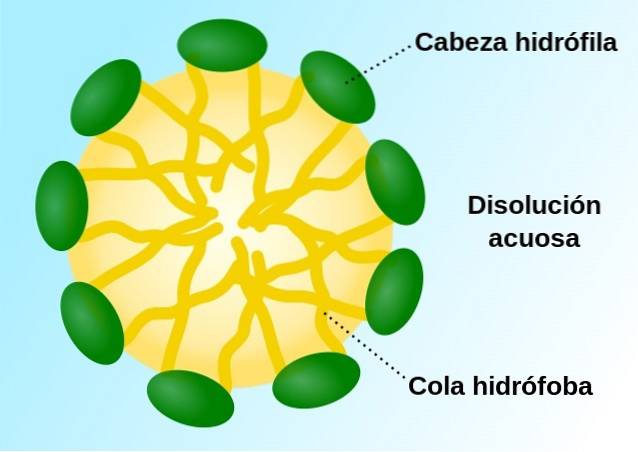
le micelles Ce sont des structures sphériques stables constituées de centaines de molécules amphipathiques, c'est-à-dire des molécules caractérisées par une région polaire (hydrophile) et apolaire (hydrophobe). Comme les molécules qui les composent, les micelles ont un centre fortement hydrophobe et leur surface est "tapissée" de groupes polaires hydrophiles..
Ils résultent, dans la plupart des cas, du mélange d'un groupe de molécules amphipathiques avec de l'eau, c'est donc un moyen de «stabiliser» les régions hydrophobes de nombreuses molécules ensemble, un fait qui est entraîné par l'effet hydrophobe et organisé par van der Forces de Waals.
Les détergents et les savons, ainsi que certains lipides cellulaires, peuvent former des micelles, qui ont une pertinence fonctionnelle, au moins chez les animaux, du point de vue de l'absorption des graisses et du transport des substances liposolubles..
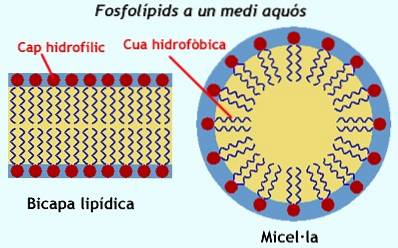
Les phospholipides, l'une des classes de lipides les plus abondantes et les plus importantes pour les cellules vivantes, peuvent dans certaines conditions former, en plus des liposomes et des bicouches, des structures micellaires.
Les micelles peuvent également être formées dans un milieu apolaire et dans ce cas elles sont appelées "micelles inverses", car les régions polaires des molécules amphipathiques qui les forment sont "cachées" dans le centre hydrophile tandis que les parties apolaires sont en contact direct avec le moyen. qui les contient.
Index des articles
- 1 Structure
- 1.1 Organisation
- 2 Fonction
- 3 Formation
- 4 Références
Structure
Les micelles sont constituées de molécules amphipathiques ou, en d'autres termes, de molécules qui ont une région hydrophile (hydrophile, polaire) et une autre région hydrophobe (hydrofuge, apolaire).
Ces molécules comprennent les acides gras, les molécules de tout détergent et les phospholipides des membranes cellulaires, par exemple.
Dans le contexte cellulaire, une micelle est couramment composée d'acides gras (de longueur variable), dont les groupements carboxyle polaires sont exposés vers la surface de l'agrégat, tandis que les chaînes hydrocarbonées sont «cachées» dans un centre hydrophobe, adoptant ainsi un plus ou moins de structure sphérique.
Les phospholipides, qui sont d'autres molécules amphipathiques de grande importance pour les cellules, sont généralement incapables de former des micelles, car les deux chaînes d'acides gras qui composent leurs "queues hydrophobes" occupent une grande taille et rendent toute forme difficile à remplir. Sphérique.
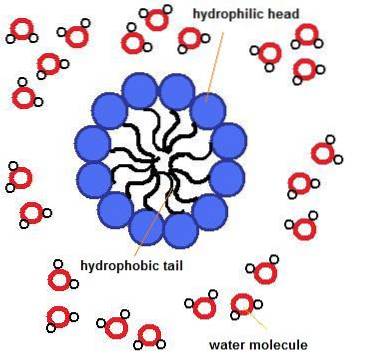
Au lieu de cela, lorsque ces molécules sont dans un milieu aqueux, elles «se nichent» dans des bicouches (semblables à un sandwich); c'est-à-dire dans des structures plus plates, où chacune des «surfaces» exposées vers le milieu est composée des têtes polaires des groupes attachés au glycérol et le «remplissage» du sandwich est constitué des queues hydrophobes (les acides gras estérifiés en les deux autres carbones du squelette glycérol).
La seule manière dont il est possible pour un phospholipide de participer à la formation d'une micelle est lorsque l'une de ses deux chaînes d'acides gras est éliminée par hydrolyse..
Organisation
Dans une micelle, comme mentionné, le «centre» séquestre les parties apolaires des molécules qui les composent et les isole de l'eau..
La région centrale d'une micelle est donc constituée d'un environnement hautement désordonné, aux caractéristiques fluides, dans lequel la mesure du rayon est entre 10 et 30% plus petite que celle des chaînes entièrement étendues de molécules non amphipathiques associées au complexe moléculaire.
De même, la surface d'une micelle n'est pas homogène mais plutôt "rugueuse" et hétérogène, dont certaines études de résonance magnétique nucléaire indiquent que seul un tiers est couvert par les parties polaires des monomères constitutifs..
Une fonction
Les micelles ont des fonctions très importantes, tant dans la nature que dans l'industrie et dans la recherche.
Concernant leurs fonctions dans la nature, ces agrégats moléculaires sont particulièrement importants pour l'absorption intestinale des graisses (monoglycérides et acides gras), car des micelles de tailles et de compositions différentes peuvent se former à partir des molécules grasses ingérées avec les aliments et les transporter à l'intérieur des cellules. de la muqueuse intestinale, permettant leur absorption.
Les micelles fonctionnent également dans le transport du cholestérol (une autre classe de lipides cellulaires) acquis avec l'alimentation et de certaines vitamines dites «liposolubles», c'est pourquoi elles sont également exploitées pharmacologiquement pour le transport et l'administration de médicaments aux caractéristiques apolaires..
Les détergents et savons utilisés quotidiennement pour l'hygiène intime ou pour le nettoyage de différents types de surfaces sont composés de molécules lipidiques capables de former des micelles lorsqu'elles sont en solution aqueuse..
Ces micelles se comportent comme de minuscules billes dans un roulement, donnant aux solutions savonneuses leur consistance glissante et leurs propriétés lubrifiantes. L'action de la plupart des détergents dépend fortement de leur capacité à produire des micelles..
Dans la recherche et l'étude des protéines membranaires, par exemple, des détergents sont utilisés pour «purifier» les lysats cellulaires des lipides qui forment les bicouches caractéristiques des membranes, ainsi que pour séparer les protéines membranaires intégrales des composants hydrophobes..
Formation
Pour comprendre la formation des structures micellaires, notamment dans les détergents, il est nécessaire de prendre en compte un concept un peu abstrait: la concentration micellaire critique ou CMC..
La concentration micellaire critique est la concentration de molécules amphipathiques à laquelle les micelles commencent à se former. Il s'agit d'une valeur de référence au-dessus de laquelle une augmentation de la concentration de ces molécules ne se terminera que par une augmentation du nombre de micelles, et en dessous de laquelle celles-ci sont préférentiellement organisées en couches à la surface du milieu aqueux qui les contient..
Ainsi, la formation de micelles est une conséquence directe de «l'amphiphilicité» des tensioactifs et dépend fortement de leurs caractéristiques structurelles, notamment de la relation de forme et de taille entre les groupes polaires et apolaires..
En ce sens, la formation de micelles est favorisée lorsque la section transversale du groupe polaire est beaucoup plus grande que celle du groupe apolaire, comme cela se produit avec les acides gras libres, avec les lysophospholipides et avec des détergents tels que le dodécyl sulfate de sodium ( SDS).
Deux autres paramètres dont dépend la formation des micelles sont:
- Température: La température micellaire critique (CMT) a également été définie. température micellaire critique) qui est la température au-dessus de laquelle la formation de micelles est favorisée
- Force ionique: qui concerne surtout les détergents ou tensioactifs de type ionique (dont le groupe polaire a une charge)
Les références
- Hassan, P. A., Verma, G., et Ganguly, R. (2011). 1 Matériaux souples À Propriétés et applications. Matériaux fonctionnels: préparation, traitement et applications, 1.
- Lodish, H., Berk, A., Kaiser, C. A., Krieger, M., Scott, M. P., Bretscher, A.,… et Matsudaira, P. (2008). Biologie cellulaire moléculaire. Macmillan.
- Luckey, M. (2014). Biologie structurale membranaire: avec fondements biochimiques et biophysiques. la presse de l'Universite de Cambridge.
- Nelson, D. L. et Cox, M. M. (2009). Principes de Lehninger de la biochimie (pp. 71-85). New York: WH Freeman.
- Tanford, C. (1972). Forme et taille des micelles. Le Journal of Physical Chemistry, 76 (21), 3020-3024.
- Zhang, Y., Cao, Y., Luo, S., Mukerabigwi, J. F., et Liu, M. (2016). Nanoparticules en tant que systèmes d'administration de médicaments de thérapie combinée pour le cancer. Dans Nanobiomaterials in Cancer Therapy (pp. 253-280). William Andrew Publishing.


Personne n'a encore commenté ce post.