
Myofibrilles caractéristiques, structure, composition, fonctions

le myofibrilles Ce sont les unités structurelles des cellules musculaires, également appelées fibres musculaires. Elles sont très abondantes, sont disposées en parallèle et sont noyées par le cytosol de ces cellules.
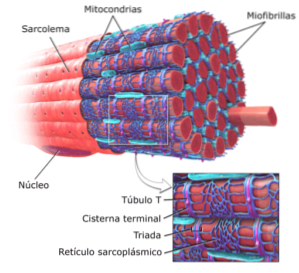
Les cellules ou fibres musculaires striées sont des cellules très longues, mesurant jusqu'à 15 cm de longueur et de 10 à 100 μm de diamètre. Sa membrane plasmique est connue sous le nom de sarcolemme et son cytosol sous le nom de sarcoplasme..
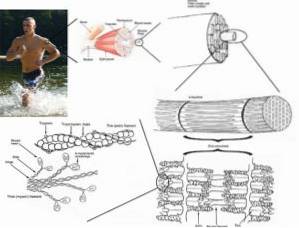
Au sein de ces cellules se trouvent, en plus des myofibrilles, plusieurs noyaux et mitochondries appelés sarcosomes, ainsi qu'un réticulum endoplasmique proéminent connu sous le nom de réticulum sarcoplasmique..
Les myofibrilles sont reconnues comme les «éléments contractiles» des muscles chez les animaux vertébrés. Ils sont composés de plusieurs types de protéines qui leur confèrent les caractéristiques élastiques et rétractables. De plus, ils occupent une part importante du sarcoplasme des fibres musculaires.
Index des articles
- 1 Différences entre les fibres musculaires
- 2 Caractéristiques générales
- 2.1 Formation de myofibrilles ou «myofibrillogenèse»
- 3 Structure et composition
- 3.1 - Myofilaments fins
- 3.2 - Myofilaments épais
- 3.3 - Protéines associées
- 4 fonctions
- 5 Références
Différences entre les fibres musculaires
Il existe deux types de fibres musculaires: les fibres striées et lisses, chacune avec une répartition anatomique et une fonction spécifique. Les myofibrilles sont particulièrement importantes et évidentes dans les fibres musculaires striées qui composent le muscle squelettique..
Les fibres striées présentent un motif répétitif de bandes transversales lorsqu'elles sont observées au microscope et sont associées aux muscles squelettiques et à une partie des muscles cardiaques..
Les fibres lisses, en revanche, ne présentent pas le même motif au microscope et se retrouvent dans les muscles caractéristiques du système vasculaire et digestif (et de tous les viscères).
Caractéristiques générales
Les myofibrilles sont constituées de deux types de filaments contractiles (également appelés myofilaments), qui à leur tour sont constitués des protéines filamenteuses myosine et actine, qui seront décrites plus loin..
Différents chercheurs ont déterminé que la demi-vie des protéines contractiles des myofibrilles varie de 5 jours à 2 semaines, de sorte que le muscle est un tissu hautement dynamique, non seulement du point de vue contractile, mais aussi de la synthèse et du renouvellement. point de vue de ses éléments structurels.
L'unité fonctionnelle de chaque myofibrille dans les cellules ou fibres musculaires est appelée sarcomère et est délimitée par une région connue sous le nom de «bande ou ligne Z», à partir de laquelle s'étendent les myofilaments d'actine en ordre parallèle..
Les myofibrilles occupant une partie substantielle du sarcoplasme, ces structures fibreuses restreignent la localisation des noyaux des cellules auxquelles elles appartiennent vers la périphérie des cellules, à proximité du sarcolemme..
Certaines pathologies humaines sont liées au déplacement des noyaux dans les faisceaux myofibrillaires, et celles-ci sont connues sous le nom de myopathies centro-nucléaires.
Formation de myofibrilles ou «myofibrillogenèse»
Les premières myofibrilles sont assemblées lors du développement du muscle squelettique embryonnaire.
Les protéines qui composent les sarcomères (les unités fonctionnelles des myofibrilles) sont initialement alignées à partir des extrémités et des côtés des «prémiofibrilles» qui sont composées de filaments d'actine et de petites portions de myosine II non musculaire et d'α-actine spécifique du muscle.
Lorsque cela se produit, les gènes codant pour les isoformes cardiaques et squelettiques de l'α-actine sont exprimés dans des proportions différentes dans les fibres musculaires. D'abord la quantité d'isoforme cardiaque qui est exprimée est plus grande et ensuite cela change vers le squelette.
Après la formation des prémiofibrilles, les myofibrilles naissantes s'assemblent derrière la zone de formation des prémiofibrilles et dans celles-ci la forme de myosine II musculaire est détectée..
À ce stade, les filaments de myosine s'alignent et se complexent avec d'autres protéines spécifiques de liaison à la myosine, ce qui se produit également avec les filaments d'actine..
Structure et composition
Comme discuté il y a un instant, les myofibrilles sont composées de myofilaments de protéines contractiles: l'actine et la myosine, également appelées myofilaments minces et épais, respectivement. Ceux-ci sont visibles au microscope optique.
- Myofilaments minces
Les filaments minces des myofibrilles sont constitués de la protéine actine sous sa forme filamenteuse (actine F), qui est un polymère de forme globulaire (actine G), de plus petite taille.
Les brins filamenteux de G-actine (F-actine) forment un double brin qui s'enroule en une hélice. Chacun de ces monomères pèse plus ou moins 40 kDa et est capable de se lier à la myosine en des sites particuliers..
Ces filaments ont un diamètre d'environ 7 nm et s'étendent entre deux zones dites bande I et bande A. Dans la bande A, ces filaments sont situés autour des filaments épais formant un agencement hexagonal secondaire..
Plus précisément, chaque filament mince est symétriquement séparé de trois filaments épais, et chaque filament épais est entouré de six filaments minces.
Les filaments fins et épais interagissent entre eux à travers des «ponts croisés» qui dépassent des filaments épais et apparaissent dans la structure myofibrille à intervalles réguliers de distances proches de 14 nm..
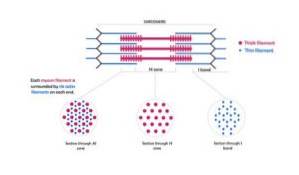
Les filaments d'actine et d'autres protéines associées s'étendent au-delà des "bords" des lignes Z et chevauchent les filaments de myosine vers le centre de chaque sarcomère..
- Myofilaments épais
Les filaments épais sont des polymères de la protéine myosine II (510 kDa chacun) et sont délimités par des régions appelées «bandes A».
Les myofilaments de myosine mesurent environ 16 nm de long et sont disposés en agencements hexagonaux (si une section transversale d'une myofibrille est observée).
Chaque filament de myosine II est composé de nombreuses molécules de myosine tassées, chacune constituée de deux chaînes polypeptidiques qui ont une région en forme de club ou «tête» et qui sont disposées en «faisceaux» pour former les filaments..
Les deux faisceaux sont maintenus à travers leurs extrémités au centre de chaque sarcomère, de sorte que les «têtes» de chaque myosine soient dirigées vers la ligne Z, où les filaments minces sont attachés..
Les têtes de myosine remplissent des fonctions très importantes, car elles ont des sites de liaison pour les molécules d'ATP et, de plus, lors de la contraction musculaire, elles sont capables de former des ponts croisés pour interagir avec les fins filaments d'actine..
- Protéines associées
Les filaments d'actine sont «ancrés» ou «fixés» à la membrane plasmique des fibres musculaires (sarcolemme) grâce à leur interaction avec une autre protéine appelée dystrophine.
En outre, il existe deux importantes protéines de liaison à l'actine connues sous le nom de troponine et de tropomyosine qui, avec les filaments d'actine, forment un complexe protéique. Les deux protéines sont essentielles pour la régulation des interactions qui ont lieu entre les filaments fins et épais..
La tropomyosine est également une molécule filamenteuse à deux brins qui s'associe à des hélices d'actine spécifiquement dans la région des rainures entre les deux brins. La troponine est un complexe protéique globulaire tripartite qui est disposé à intervalles sur les filaments d'actine.
Ce dernier complexe fonctionne comme un «interrupteur» dépendant du calcium qui régule les processus de contraction des fibres musculaires, c'est pourquoi il est de la plus haute importance..
Dans le muscle strié des animaux vertébrés, il existe en outre deux autres protéines qui interagissent avec les filaments épais et minces, respectivement appelées titine et nébuline..
La nébuline a des fonctions importantes dans la régulation de la longueur des filaments d'actine, tandis que la titine participe au support et à l'ancrage des filaments de myosine dans une région du sarcomère connue sous le nom de ligne M..
Autres protéines
Il existe d'autres protéines associées aux myofilaments épais connus sous le nom de protéine C de liaison à la myosine et de myomesine, responsables de la fixation des filaments de myosine dans la lignée M..
Caractéristiques
Les myofibrilles ont des implications élémentaires sur la capacité de mouvement des animaux vertébrés.
Puisqu'ils sont constitués par les complexes protéiques fibreux et contractiles de l'appareil musculaire, ceux-ci sont essentiels pour exécuter les réponses aux stimuli nerveux qui conduisent au mouvement et au déplacement (dans les muscles striés squelettiques).
Les propriétés dynamiques incontestables du muscle squelettique, qui représentent plus de 40% du poids corporel, sont conférées par les myofibrilles qui, dans le même temps, possèdent entre 50 et 70% des protéines du corps humain.
Les myofibrilles, faisant partie de ces muscles, participent à toutes ses fonctions:
- Mécanique: convertir l'énergie chimique en énergie mécanique pour générer de la force, maintenir la posture, produire des mouvements, etc..
- Métabolique: puisque le muscle participe au métabolisme énergétique de base et sert de site de stockage pour des substances fondamentales telles que les acides aminés et les glucides; Il contribue également à la production de chaleur et à la consommation d'énergie et d'oxygène utilisés lors d'activités physiques ou d'exercices sportifs.
Les myofibrilles étant principalement composées de protéines, elles représentent un site de stockage et de libération d'acides aminés qui contribuent au maintien de la glycémie pendant le jeûne ou la famine..
En outre, la libération d'acides aminés de ces structures musculaires est importante du point de vue des besoins biosynthétiques d'autres tissus tels que la peau, le cerveau, le cœur et d'autres organes..
Les références
- Despopoulos, A. et Silbernagl, S. (2003). Atlas des couleurs de la physiologie (5e éd.). New York: Thieme.
- Friedman, A. L. et Goldman, Y. E. (1996). Caractérisation mécanique des myofibrilles des muscles squelettiques. Journal biophysique, 71(5), 2774-2785.
- Frontera, W. R. et Ochala, J. (2014). Muscle squelettique: un bref examen de la structure et de la fonction. Tissu Calcif Int, Quatre cinq(2), 183-195.
- Goldspink, G. (1970). La prolifération des myofibrilles pendant la croissance des fibres musculaires. J. Cell Sct., 6, 593-603.
- Murray, R., Bender, D., Botham, K., Kennelly, P., Rodwell, V. et Weil, P. (2009). La biochimie illustrée de Harper (28e éd.). McGraw-Hill Médical.
- Rosen, J. N., et Baylies, M. K. (2017). Les myofibrilles exercent une pression sur les noyaux. Biologie cellulaire de la nature, 19(dix).
- Sanger, J., Wangs, J., Fan, Y., White, J., Mi-Mi, L., Dube, D.,… Pruyne, D. (2016). Assemblage et entretien des myofibrilles dans le muscle strié. Dans Manuel de pharmacologie expérimentale (p. 37). New York, États-Unis: Springer International Publishing Suisse.
- Sanger, J. W., Wang, J., Fan, Y., White, J., et Sanger, J. M. (2010). Assemblage et dynamique des myofibrilles. Journal de la biomédecine et de la biotechnologie, 2010, 8.
- Sobieszek, A. et Bremel, R. (1975). Préparation et propriétés des vertébrés lisses - myofibrilles musculaires et actomyosine. Journal européen de biochimie, 55(1), 49-60.
- Villee, C., Walker, W., et Smith, F. (1963). Zoologie générale (2e éd.). Londres: Compagnie W. B. Saunders.


Personne n'a encore commenté ce post.