
Structure, propriétés, utilisations du nitrate de magnésium (Mg (NO3) 2)

le nitrate de magnésium est un solide inorganique dont la formule chimique est Mg (NO3)deux. C'est un composé ionique formé par l'union d'un cation magnésium Mgdeux+ et deux anions nitrate NO3-.
Mg (NON3)deux c'est un solide cristallin blanc. Il est très hygroscopique, c'est-à-dire qu'il absorbe facilement l'eau de l'environnement. Lorsqu'il reste en contact avec l'air ambiant, il a tendance à former son Mg hexahydraté (NO3)deux•6HdeuxOU ALORS.

Nitrate de magnésium hexahydraté Mg (NO3)deux•6HdeuxO a dans sa structure cristalline 6 molécules d'eau HdeuxOu pour chaque molécule de Mg (NON3)deux. Le nitrate de magnésium se trouve dans les grottes et les mines sous la forme du minéral nitromagnésite.
Mg (NON3)deux obtenu dans le commerce en faisant réagir du magnésium métallique Mg avec de l'acide nitrique HNO3.
Il a une grande variété d'utilisations, par exemple en agriculture comme engrais car il fournit des nutriments pour les plantes tels que l'azote (N) et le magnésium (Mg)..
Il est utilisé dans l'industrie pyrotechnique ou pyrotechnique ainsi que dans l'obtention d'acide nitrique concentré. Utilisé dans l'analyse chimique, les expériences de physique et les études médicales et scientifiques.
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Point d'ébullition
- 3.5 Densité
- 3.6 Solubilité
- 3.7 Effet du chauffage
- 4 Obtention
- 4.1 Emplacement dans la nature
- 5 utilisations
- 5.1 Dans des études récentes
- 5.2 Dans les études sur la maladie
- 6 Références
Structure
Le nitrate de magnésium anhydre est composé d'un cation magnésium Mgdeux+ et deux anions nitrate NO3-.
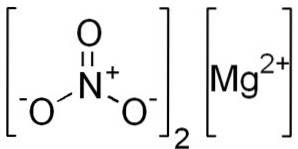
Magnésium ion Mgdeux+ possède la configuration électronique: 1sdeux, 2 sdeux 2 P6, 3 s0, car il a produit les deux électrons de la coque la plus externe (3s). Cette conformation est très stable.
L'ion NO3- a une structure plate et symétrique.
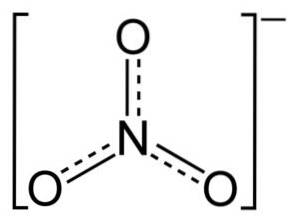
Dans la structure de NON3- la charge négative est répartie en continu entre les trois atomes d'oxygène.
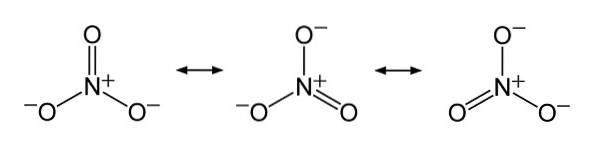
Nomenclature
-Nitrate de magnésium anhydre: Mg (NO3)deux
-Nitrate de magnésium dihydraté: Mg (NO3)deux•2HdeuxOU ALORS
-Nitrate de magnésium hexahydraté: Mg (NO3)deux•6HdeuxOU ALORS
-Dinitrate de magnésium
Propriétés
État physique
-Mg (NON3)deux anhydre: solide blanc, cristaux cubiques.
-Mg (NON3)deux dihydraté: solide cristallin blanc.
-Mg (NON3)deux hexahydrate: solide incolore, cristaux monocliniques
Poids moléculaire
-Mg (NON3)deux anhydre: 148,31 g / mol
-Mg (NON3)deux hexahydraté: 256,41 g / mol
Point de fusion
-Mg (NON3)deux hexahydraté: 88,9 ºC
Point d'ébullition
-Mg (NON3)deux hexahydraté: ne bout pas, se décompose à 330 ºC
Densité
-Mg (NON3)deux anhydre: 2,32 g / cm3
-Mg (NON3)deux dihydraté: 1,456 g / cm3
-Mg (NON3)deux hexahydraté: 1464 g / cm3
Solubilité
Le nitrate de magnésium anhydre est très soluble dans l'eau: 62,1 g / 100 mL à 0 ºC; 69,5 g / 100 mL à 20 ° C Il est également très hygroscopique, le contact avec l'air forme rapidement l'hexahydrate.
Mg (NON3)deux le dihydrate est également très soluble dans l'eau et l'éthanol. C'est hygroscopique.
Mg (NON3)deux l'hexahydrate est également très soluble dans l'eau. Il est modérément soluble dans l'éthanol. C'est le plus stable des trois au contact de l'air, c'est-à-dire que des trois c'est celui qui absorbe le moins d'eau de l'environnement.
Effet chauffant
En soumettant une solution aqueuse de Mg (NO3)deux Lors de l'évaporation de l'eau, le sel qui cristallise est l'hexahydrate: Mg (NO3)deux•6HdeuxO. Hexahydrate signifie que dans le solide, chaque molécule de Mg (NO3)deux est lié à 6 molécules d'eau.
Il y a aussi le dihydrate Mg (NO3)deux•2HdeuxOu, dans lequel Mg (NON3)deux le solide est lié à 2 molécules d'eau.
Chauffage Mg hexahydraté (NO3)deux•6HdeuxOu le sel anhydre n'est pas obtenu, car le nitrate de magnésium a une forte affinité pour l'eau.
Pour cette raison, lorsqu'il est chauffé au-dessus de son point de fusion, il forme initialement un sel mixte de nitrate de magnésium et d'hydroxyde de Mg (NO3)deux•4 mg (OH)deux.
Ce sel mélangé, lorsqu'il atteint 400 ºC, se décompose en oxyde de magnésium MgO et des gaz d'oxyde d'azote sont libérés..
Obtention
Il peut être préparé en faisant réagir du carbonate de magnésium MgCO3 avec de l'acide nitrique HNO3, dégageant du dioxyde de carbone COdeux:
MgCO3 + 2 HNO3 → Mg (NON3)deux + COdeux↑ + HdeuxOU ALORS
Il peut également être obtenu avec de l'hydroxyde de magnésium Mg (OH)deux et acide nitrique:
Mg (OH)deux + 2 HNO3 → Mg (NON3)deux + 2 heuresdeuxOU ALORS
Commercialement, il est obtenu de plusieurs manières:
1- Réaction du magnésium métal Mg avec de l'acide nitrique HNO3.
2- En faisant réagir l'oxyde de magnésium MgO avec l'acide nitrique HNO3.
3- Liaison de l'hydroxyde de magnésium Mg (OH)deux et nitrate d'ammonium NH4NE PAS3, formation du nitrate de magnésium avec dégagement d'ammoniaque NH3.
Emplacement dans la nature
Mg (NON3)deux l'hexahydrate se trouve naturellement dans les mines et les grottes ou cavernes sous forme de nitromagnésite minérale.
Ce minéral est présent lorsque le guano entre en contact avec des roches riches en magnésium. Le guano est le matériau résultant des excréments d'oiseaux de mer et de phoques dans des environnements très secs..
Applications
Mg (NON3)deux l'hexahydrate est utilisé dans les industries céramique, chimique et agricole.
Ce composé est un engrais car il fournit de l'azote (N), qui est l'un des trois éléments de base nécessaires aux plantes, et du magnésium (Mg), qui est un composant secondaire également important pour les plantes..
De cette façon, il est utilisé avec d'autres ingrédients dans les serres et dans la culture hydroponique. Ce dernier consiste à cultiver les plantes dans une solution aqueuse avec des sels d'engrais au lieu de terre.

Il est également utilisé comme catalyseur pour l'obtention de composés pétrochimiques. Il permet d'ajuster la viscosité dans certains procédés. Le nitrate de magnésium anhydre est utilisé dans la pyrotechnie, c'est-à-dire pour la fabrication de feux d'artifice.

Le nitrate de magnésium anhydre est un agent déshydratant. Il est utilisé, par exemple, pour obtenir de l'acide nitrique concentré, car il élimine l'eau et concentre les vapeurs d'acide jusqu'à 90-95% HNO3.

Il est également utilisé pour enrober du nitrate d'ammonium et permettre la formation de billes de ce matériau comprimé..
Il est utile dans la formulation d'encres, de toner (poudre noire utilisée dans les systèmes de photocopie) et de produits colorants. Sert d'étalon de magnésium en chimie analytique.
Le sel de nitrate de magnésium et de cérium Mg (NO3)deux•Dîne3)3 Il est intéressant dans les expériences de physique à basses températures, car il est utilisé comme fluide caloporteur dans les expériences de démagnétisation adiabatique (sans transfert de chaleur).
Ce sel de magnésium et de cérium a été utilisé pour établir des niveaux de température extrêmement bas sur l'échelle Kelvin (proche du zéro absolu)..
Dans des études récentes
Plusieurs chercheurs ont utilisé Mg (NO3)deux dans des compositions avec des polymères synthétiques et naturels pour augmenter la conductivité dans les batteries au magnésium ionique.
Il a également été étudié dans la construction de supercondensateurs pour le stockage d'énergie à haute puissance.
Dans les études sur les maladies
Le nitrate de magnésium a été administré à des rats de laboratoire souffrant d'hypertension artérielle (haute pression) et s'est avéré efficace pour abaisser la tension artérielle et atténuer ou atténuer les effets des complications de cette maladie..
Il a également montré des effets protecteurs contre les troubles neurologiques (troubles neuronaux) et contre la mort chez le rat lors des processus de colmatage de l'artère carotide..
Les références
- Qian, M. et coll. (2018). Carbones poreux extraordinaires à quelques couches de haute capacité provenant de la combustion Pechini de gel de nitrate de magnésium. ACS Appl Mater Interfaces 2018, 10 (1): 381-388. Récupéré de ncbi.nlm.nih.gov.
- Manjuladevi, R. et al. (2018). Une étude sur un mélange d'électrolyte polymère à base de poly (alcool vynil) -poly (acrylonitrile) avec du nitrate de magnésium pour batterie de magnésium. Ionics (2018) 24: 3493. Récupéré de link.springer.com.
- Kiruthika, S. et coll. (2019). Electrolyte biopolymère écologique, pectine avec sel de nitrate de magnésium, pour application dans les appareils électrochimiques. J Solid State Electrochem (2019) 23: 2181. Récupéré de link.springer.com.
- Vilskerts R. et coll. (2014). Le nitrate de magnésium atténue l'augmentation de la pression artérielle chez les rats SHR. Magnes Res 2014, 27 (1): 16-24. Récupéré de ncbi.nlm.nih.gov.
- Kuzenkov V.S. et Krushinskii A.L. (2014). Effet protecteur du nitrate de magnésium contre les troubles neurologiques provoqués par l'ischémie cérébrale chez le rat. Bull Exp Biol Med 2014, 157 (6): 721-3. Récupéré de ncbi.nlm.nih.gov.
- Ropp, R.C. (2013). Composés alcalino-terreux du groupe 15 (N, P, As, Sb et Bi). Nitrate de magnésium. Dans l'Encyclopédie des composés alcalino-terreux. Récupéré de sciencedirect.com.
- Kirk-Othmer (1994). Encyclopédie de la technologie chimique. Volume 1. Quatrième édition. John Wiley et fils.
- NOUS. Bibliothèque nationale de médecine. (2019). Nitrate de magnésium. Récupéré de: pubchem.ncbi.nlm.nih.gov.



Personne n'a encore commenté ce post.