
Propriétés, structure, utilisations, risques de l'oxalate de calcium (CaC2O4)
le Oxalate de calcium C'est un composé organique formé des éléments carbone (C), oxygène (O) et calcium (Ca). Sa formule chimique est CaCdeuxOU ALORS4. On le trouve généralement sous ses trois formes hydratées: mono-, di- et trihydrate. C'est-à-dire avec une, deux ou trois molécules d'eau respectivement dans sa structure cristalline..
L'oxalate de calcium se trouve dans les minéraux, les plantes, les champignons et d'autres êtres vivants tels que les mammifères et même chez les humains en raison du métabolisme de certaines protéines. Il peut être trouvé dans l'urine des humains et de certains animaux.
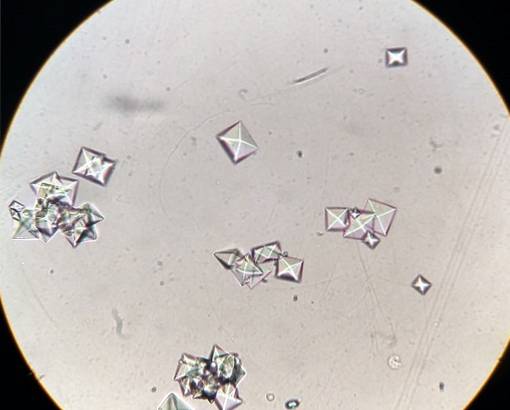
Certains aliments comme les épinards, la rhubarbe, le soja et le chocolat contiennent beaucoup d'oxalates, et lorsque les personnes sensibles les mangent, des calculs d'oxalate de calcium peuvent se former dans leurs reins..
Les calculs de CaC peuvent être évitésdeuxOU ALORS4 dans les reins s'ils ingèrent beaucoup de liquides, en particulier de l'eau, en évitant les aliments riches en oxalates et en consommant ceux riches en calcium et en magnésium.
L'oxalate de calcium forme du tartre indésirable dans les tuyaux et les réservoirs dans des processus tels que la fabrication de pâte et papier, ainsi que dans les brasseries.
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Poids spécifique
- 3.5 Solubilité
- 3,6 pH
- 3.7 Propriétés chimiques
- 4 Présence dans la nature
- 4.1 Dans les minéraux
- 4.2 Dans les plantes et les champignons
- 5 Présence dans le corps humain et les mammifères
- 5.1 Chez l'homme
- 5.2 Facteurs qui affectent l'apparition de calculs dans les reins
- 5.3 Moyens d'éviter la formation de calculs d'oxalate de calcium
- 5.4 Chez les animaux
- 5.5 Réponse corporelle à un excès d'oxalate
- 6 utilisations
- 6.1 Problèmes dans certains processus
- 7 risques
- 8 Références
Structure
L'oxalate de calcium est formé par l'ion calcium Cadeux+ et l'ion oxalate CdeuxOU ALORS4deux-. L'anion oxalate est composé de deux atomes de carbone et de quatre atomes d'oxygène. Les charges négatives de l'anion oxalate se trouvent sur les atomes d'oxygène.
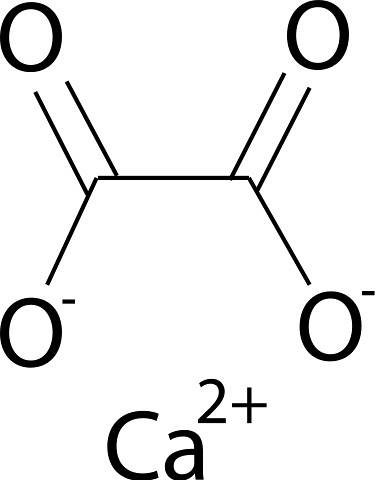
Nomenclature
- Oxalate de calcium
- Sel de calcium d'acide oxalique
- Sel de calcium d'acide éthanedioïque
Propriétés
État physique
Solide cristallin incolore, blanc, jaune ou brun pouvant se présenter sous trois formes hydratées différentes.
Poids moléculaire
128,1 g / mol
Point de fusion
L'oxalate de calcium monohydraté se décompose à 200 ° C.
Poids spécifique
CaC monohydratédeuxOU ALORS4 •HdeuxO = 2,22 g / cm3
Dihydrate de CaCdeuxOU ALORS4 •2HdeuxO = 1,94 g / cm3
CaC trihydratédeuxOU ALORS4 •3HdeuxO = 1,87 g / cm3
Solubilité
Presque insoluble dans l'eau: 0,00061 g / 100 g d'eau à 20 ° C. Le monohydrate se dissout dans l'acide dilué.
pH
Les solutions aqueuses d'oxalate de calcium sont faiblement basiques.
Propriétés chimiques
L'oxalate de calcium est le sel de calcium de l'acide oxalique. C'est un sous-produit naturel du métabolisme, il est donc très abondant dans le corps humain et fait partie de nombreux aliments.
L'acide oxalique et sa base conjuguée, l'oxalate, sont des composés organiques hautement oxydés, avec une puissante activité chélatrice, c'est-à-dire qu'ils peuvent facilement se combiner avec des ions positifs avec des charges de +2 ou +3.
Ses solutions aqueuses sont faiblement basiques car l'ion oxalate a tendance à absorber les protons H.+ de l'eau, qui libère des ions OH-. Après avoir pris deux protons H+ l'ion oxalate devient l'acide oxalique HdeuxCdeuxOU ALORS4:
CdeuxOU ALORS4deux- + HdeuxO → HCdeuxOU ALORS4- + Oh-
HCdeuxOU ALORS4- + HdeuxO → HdeuxCdeuxOU ALORS4 + Oh-
Présence dans la nature
En minéraux
L'oxalate de calcium est l'oxalate le plus courant et se présente sous la forme de minéraux whewellite, weddellite et caoxite..
Whewellite est le CaC monohydratédeuxOU ALORS4 •HdeuxOu et est la forme la plus stable de ce composé.

Weddellite est le CaC dihydratédeuxOU ALORS4 •2HdeuxO et est moins stable que le monohydrate.

Caoxite est l'oxalate de calcium trihydraté CaCdeuxOU ALORS4 •3HdeuxOU ALORS.
Dans les plantes et les champignons
L'oxalate de calcium se trouve associé aux sols secs et aux feuilles, également aux champignons pathogènes, libres, en symbiose ou associés aux plantes. Dans ce dernier, des cristaux sont formés par la précipitation du calcium sous la forme de son oxalate..
Formation de CaCdeuxOU ALORS4 par les champignons a une influence importante sur les processus biologiques et géochimiques des sols, car il constitue une réserve de calcium pour l'écosystème.
Présence dans le corps humain et les mammifères
L'oxalate provient du foie, des globules rouges ou des érythrocytes et, dans une moindre mesure, du rein. Il est formé à partir du métabolisme des acides aminés (tels que la phénylalanine et le tryptophane) et par oxydation du glyoxal dialdéhyde,.
La vitamine C peut également être convertie en oxalate lors de l'exécution de sa fonction antioxydante.
L'oxalate de calcium se trouve dans les calculs qui se forment dans les reins des personnes ou des animaux atteints d'une maladie rénale..
Les pierres ou pierres dites d'oxalate de calcium sont formées par la cristallisation ou l'agrégation de CaCdeuxOU ALORS4 dans les urines sursaturées de calcium et d'oxalate. Cela signifie que l'urine contient tellement de calcium et d'oxalate qu'il n'est pas possible pour ce composé de rester dissous, mais plutôt de précipiter ou de passer à l'état solide sous forme de cristaux..
Chez les humains
La formation de gravier ou de calculs dans les reins est une maladie appelée néphrolithiase; attaque environ 10% de la population et environ 75% de ces calculs sont composés d'oxalate de calcium CaCdeuxOU ALORS4.
La formation et la croissance de cristaux d'oxalate de calcium dans le rein se produisent parce que chez certaines personnes, l'urine est sursaturée avec ce sel. L'oxalate de calcium se développe dans l'urine acide à un pH inférieur à 6,0.
La sursaturation se produit lorsque l'excrétion ou l'élimination de ce sel (qui est très peu soluble dans l'eau) dans l'urine se produit dans un petit volume d'eau..
Facteurs qui affectent l'apparence des calculs rénaux
Parmi les facteurs favorisant la formation de grains d'oxalate de calcium figurent l'excès de calcium dans les urines ou l'hypercalciurie, l'excès d'oxalate dans les urines ou l'hyperoxalurie, les éléments issus de l'alimentation et l'absence d'inhibiteurs.
Un excès d'oxalate peut se produire lorsque de grandes quantités d'épinards, de rhubarbe, de soja, de noix et de chocolat sont consommées, entre autres aliments..

Cependant, il existe des substances qui inhibent ou empêchent la formation de calculs. Les composés qui empêchent la formation de calculs comprennent de petites molécules telles que le citrate et le pyrophosphate, et de grandes molécules telles que les glycoprotéines et les protéoglycanes..
Façons d'éviter la formation de calculs d'oxalate de calcium
Une bonne stratégie pour éviter la récurrence des calculs de gravier ou d'oxalate de calcium consiste à augmenter votre apport hydrique, à augmenter votre consommation d'aliments riches en calcium (tels que les produits laitiers) et à restreindre le sel de table (NaCl), les protéines animales et les aliments riches en oxalate..
Chez les animaux
Depuis le début de l'année 2000, une augmentation des calculs d'oxalate de calcium a été observée dans le système urinaire des chats et des chiens. Il semble que cela dépende du type de régime alimentaire que ces animaux mangent et a à voir avec l'acidité de l'urine et la carence en magnésium (Mg)..
Réponse corporelle à un excès d'oxalate
Il est prouvé que les humains et les animaux réagissent à l'excès d'oxalate en augmentant le nombre de bactéries capables de décomposer l'oxalate..
Certaines de ces bactéries sont Oxalobacter formigenes, Bifidobacterium sp., Porphyromonas gingivalis Oui Bacillus sp., entre autres, et sont naturellement présents dans l'intestin.
Applications
Selon les sources consultées, l'oxalate de calcium est utilisé dans les revêtements céramiques.
Il a été utilisé pour revêtir des sculptures en calcaire et d'autres éléments artistiques, et il a été constaté qu'il améliorait la dureté du matériau, diminuait sa porosité et augmentait sa résistance aux acides et aux alcalis..

Problèmes dans certains processus
Dans l'industrie des pâtes et papiers, l'oxalate de calcium peut former du tartre, ce qui pose de nombreux problèmes dans le processus..
Pour éviter sa formation dans les conduits ou tuyaux des procédés industriels, la dégradation enzymatique de l'acide oxalique a été proposée, au moyen d'enzymes telles que l'oxalate oxydase..
Elle a également tendance à s'accumuler comme de la pierre dans les récipients où est fabriquée la bière, d'où elle doit être éliminée pour éviter la formation de microorganismes pouvant donner un goût désagréable à la boisson..
Des risques
À des concentrations élevées, l'oxalate peut entraîner la mort chez les animaux et occasionnellement chez l'homme, principalement en raison de ses effets corrosifs..
L'accumulation d'oxalate et de son acide conjugué, l'acide oxalique, peut provoquer des troubles tels qu'un dysfonctionnement cardiaque, des calculs d'oxalate de calcium, une insuffisance rénale et même la mort par toxicité.
Les références
- Glasauer, S.M. et coll. (2013). Métaux et métalloïdes, transformation par micro-organismes. Oxalates. Dans le module de référence en systèmes terrestres et sciences de l'environnement. Récupéré de sciencedirect.com.
- Baumann, J. M. et Casella, R. (2019). Prévention de la néphrolithiase calcique: l'influence de la diurèse sur la cristallisation de l'oxalate de calcium dans l'urine. Adv Prev Med, 2019; 2019: 3234867. Récupéré de ncbi.nlm.nih.gov.
- Breshears, M.A. et Confer, A.W. (2017). Le système urinaire. Calculs d'oxalate de calcium. In Pathologic Basis of Veterinary Disease (sixième édition). Récupéré de sciencedirect.com.
- Huang, Y. euh al. (2019). Manipulation de l'oxalate dans le corps tge et origine de l'oxalate dans les pierres d'oxalate de calcium. Urol Int, 5 décembre 2019: 1-10. Récupéré de ncbi.nlm.nih.gov.
- Nilvebrant, N.-O. et coll. (2002). La biotechnologie dans l'industrie des pâtes et papiers. En cours en biotechnologie. Récupéré de sciencedirect.com.
- Pahira, J.J. et Pevzner, M. (2007). Néphrolithiase. Pierres de calcium. Dans Penn Clinical Manual of Urology. Récupéré de sciencedirect.com.
- Worcester, E. M. (1994). Inhibiteurs de croissance des cristaux d'oxalate de calcium urinaire. J Am Soc Nephrol 1994 novembre; 5 (5 Suppl 1): S46-53). Récupéré de jasn.asnjournals.org.
- Finkielstein, V.A. et Goldfarb, D.S. (2006). Stratégies pour prévenir les calculs d'oxalate de calcium. Récupéré de ncbi.nlm.nih.gov.
- NOUS. Bibliothèque nationale de médecine. (2019). Oxalate de calcium. Récupéré de pubchem.ncbi.nlm.nih.gov.
- Peck, A.B. et coll. (2015). Microorganismes dégradant l'oxalate ou enzymes dégradant l'oxalate: quelle est la future thérapie pour la dissolution enzymatique des urolithes d'oxalate de calcium dans la maladie récurrente des calculs? Urolithiasis, février 2016; 44 (1): 27-32. Récupéré de ncbi.nlm.nih.gov.
- Holames, R.P. et coll. (2016). Réduire l'excrétion urinaire d'oxalate pour diminuer la maladie des calculs d'oxalate de calcium. Urolithiase. 2016 Février; 44 (1); 27-32. Récupéré de ncbi.nlm.nih.gov.
- Cezar, T.M. (1998). Oxalate de calcium: un traitement de surface pour le calcaire. Journal of Conservation and Museum Studies 4, pp. 6-10. Récupéré de jcms-journal.com.
- Wikimedia (2019). Oxalate de calcium. Récupéré de en.wikipedia.org.



Personne n'a encore commenté ce post.