
Polarité (chimie) Molécules polaires et exemples
La polarité chimique c'est une propriété qui se caractérise par la présence d'une distribution hétérogène marquée des densités électroniques dans une molécule. Dans sa structure, il y a donc des régions chargées négativement (δ-), et d'autres chargées positivement (δ +), générant un moment dipolaire.
Le moment dipolaire de liaison (µ) est une manière d'exprimer la polarité d'une molécule. Il est généralement représenté comme un vecteur dont l'origine est dans la charge (+) et son extrémité est située dans la charge (-), bien que certains chimistes le représentent inversement.
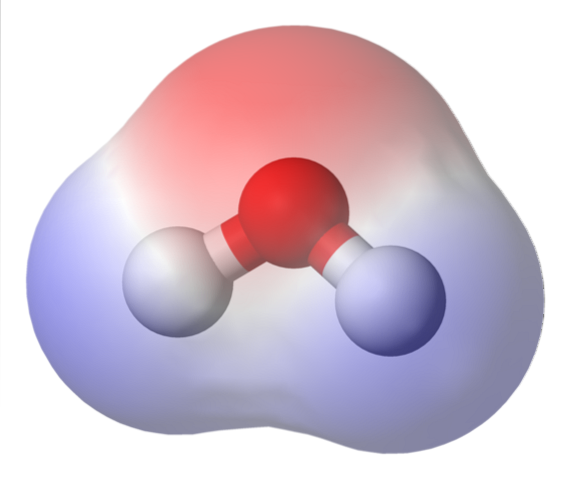
L'image du haut montre la carte du potentiel électrostatique de l'eau, HdeuxO. La région rougeâtre (atome d'oxygène) correspond à celle avec la densité électronique la plus élevée, et on peut également voir qu'elle se détache sur les régions bleues (atomes d'hydrogène).
La distribution de cette densité électronique étant hétérogène, on dit qu'il y a un pôle positif et un pôle négatif. C'est pourquoi on parle de `` polarité '' chimique et de moment dipolaire.
Index des articles
- 1 moment dipolaire
- 1.1 Asymétrie dans la molécule d'eau
- 2 molécules polaires
- 3 exemples
- 3.1 SO2
- 3,2 CHCl3
- 3,3 HF
- 3,4 NH3
- 3.5 Macromolécules à hétéroatomes
- 4 Références
Moment dipolaire
Le moment dipolaire µ est défini par l'équation suivante:
µ = δré
Où δ est la charge électrique de chaque pôle, positive (+ δ) ou négative (-δ), et ré est la distance entre eux.
Le moment dipolaire est généralement exprimé en debye, représenté par le symbole D. Un coulomb · mètre équivaut à 2,998 · 1029 ré.
La valeur du moment dipolaire de la liaison entre deux atomes différents est en relation avec la différence d'électronégativités des atomes qui forment la liaison..
Pour qu'une molécule soit polaire, il ne suffit pas d'avoir des liaisons polaires dans sa structure, mais elle doit aussi avoir une géométrie asymétrique; de telle manière qu'il empêche les moments dipolaires d'annuler les vecteurs les uns des autres.
Asymétrie dans la molécule d'eau
La molécule d'eau a deux liaisons O-H. La géométrie de la molécule est angulaire, c'est-à-dire en forme de "V"; donc les moments dipolaires des liaisons ne s'annulent pas, mais plutôt leur somme est produite en pointant vers l'atome d'oxygène.
La carte de potentiel électrostatique pour HdeuxOu refléter ça.
Si la molécule angulaire H-O-H est observée, la question suivante peut se poser: est-elle vraiment asymétrique? Si un axe imaginaire est dessiné à travers l'atome d'oxygène, la molécule se divisera en deux moitiés égales: H-O | O-H.
Mais il n'en est pas ainsi si l'axe imaginaire est horizontal. Lorsque cet axe divisera à nouveau la molécule en deux moitiés, nous aurons l'atome d'oxygène d'un côté et les deux atomes d'hydrogène de l'autre..
Pour cette raison, la symétrie apparente du HdeuxOu elle cesse d'exister, et est donc considérée comme une molécule asymétrique.
Molécules polaires
Les molécules polaires doivent répondre à une série de caractéristiques, telles que:
-La distribution des charges électriques dans la structure moléculaire est asymétrique.
-Ils sont généralement solubles dans l'eau. En effet, les molécules polaires peuvent interagir par des forces dipôle-dipôle, où l'eau est caractérisée par un grand moment dipolaire.
De plus, sa constante diélectrique est très élevée (78,5), ce qui lui permet de maintenir les charges électriques séparées en augmentant sa solubilité..
-En général, les molécules polaires ont des points d'ébullition et de fusion élevés.
Ces forces sont constituées par l'interaction dipôle-dipôle, les forces de dispersion de Londres et la formation de liaisons hydrogène..
-En raison de leur charge électrique, les molécules polaires peuvent conduire l'électricité.
Exemples
SWdeux
Dioxyde de soufre (SOdeux). L'oxygène a une électronégativité de 3,44, tandis que l'électronégativité du soufre est de 2,58. Par conséquent, l'oxygène est plus électronégatif que le soufre. Il y a deux liaisons S = O, le O ayant une charge δ- et la charge S une δ+.
Puisqu'il s'agit d'une molécule angulaire avec S au sommet, les deux moments dipolaires sont orientés dans la même direction; et par conséquent, ils s'additionnent, faisant de la molécule de SOdeux être polaire.
CHCl3
Chloroforme (HCCl3). Il y a une liaison C-H et trois liaisons C-Cl.
L'électronégativité de C est de 2,55 et l'électronégativité de H est de 2,2. Ainsi, le carbone est plus électronégatif que l'hydrogène; et donc, le moment dipolaire sera orienté de H (δ +) vers C (δ-): Cδ--Hδ+.
Dans le cas des liaisons C-Cl, C a une électronégativité de 2,55, tandis que Cl a une électronégativité de 3,16. Le vecteur dipolaire ou moment dipolaire est orienté de C vers Cl dans les trois liaisons C δ+-Cl δ-.
Comme il y a une région pauvre en électrons, autour de l'atome d'hydrogène, et une région riche en électrons composée des trois atomes de chlore, CHCl3 est considérée comme une molécule polaire.
HF
Le fluorure d'hydrogène n'a qu'une seule liaison H-F. L'électronégativité de H est de 2,22 et l'électronégativité de F est de 3,98. Par conséquent, le fluor finit avec la densité électronique la plus élevée et la liaison entre les deux atomes est mieux décrite comme: Hδ+-Fδ-.
NH3
Ammoniac (NH3) a trois liaisons N-H. L'électronégativité de N est de 3,06 et l'électronégativité de H est de 2,22. Dans les trois liaisons, la densité électronique est orientée vers l'azote, étant encore plus élevée en raison de la présence d'une paire d'électrons libres.
La molécule NH3 il est tétraédrique, l'atome N occupant le sommet. Les trois moments dipolaires, correspondant aux liaisons N-H, sont orientés dans la même direction. En eux, δ- est situé dans le N, et δ + dans le H. Ainsi, les liaisons sont: Nδ--Hδ+.
Ces moments dipolaires, l'asymétrie de la molécule et la paire d'électrons libres sur l'azote font de l'ammoniac une molécule hautement polaire..
Macromolécules à hétéroatomes
Lorsque les molécules sont très grosses, il n'est plus certain de les classer elles-mêmes comme apolaires ou polaires. En effet, certaines parties de sa structure peuvent avoir des caractéristiques à la fois apolaires (hydrophobes) et polaires (hydrophiles)..
Ces types de composés sont connus sous le nom d'amphiphiles ou d'amphipathiques. Parce que la partie apolaire peut être considérée comme pauvre en électrons par rapport à la partie polaire, il y a une polarité présente dans la structure et les composés amphiphiles sont considérés comme des composés polaires..
On peut généralement s'attendre à ce qu'une macromolécule avec des hétéroatomes ait des moments dipolaires, et donc une polarité chimique..
On entend par hétéroatomes ceux qui sont différents de ceux qui composent le squelette de la structure. Par exemple, le squelette carboné est biologiquement le plus important de tous, et l'atome avec lequel le carbone forme une liaison (en plus de l'hydrogène) est appelé un hétéroatome..
Les références
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Prof. Krishnan. (2007). Composés polaires et non polaires. Collège communautaire de St. Louis. Récupéré de: users.stlcc.edu
- Murmson, Serm. (14 mars 2018). Comment expliquer la polarité. Découvrir. Récupéré de: scaimer.com
- Helmenstine, Anne Marie, Ph.D. (5 décembre 2018). Définition et exemples de liaison polaire (liaison covalente polaire). Récupéré de: thinkco.com
- Wikipédia. (2019). Polarité chimique. Récupéré de: en.wikipedia.org
- Quimitube. (2012). Liaison covalente: polarité de la liaison et polarité moléculaire. Récupéré de: quimitube.com



Personne n'a encore commenté ce post.