
Que sont les solutions aqueuses? (Avec des exemples)
le solutions aqueuses sont ces solutions qui utilisent de l'eau pour décomposer une substance. Par exemple, de la boue ou de l'eau sucrée. Lorsqu'une espèce chimique s'est dissoute dans l'eau, cela est indiqué par l'écriture (aq) après le nom chimique.
Les substances hydrophiles (aimant l'eau) et de nombreux composés ioniques se dissolvent ou se dissocient dans l'eau. Par exemple, lorsque le sel de table ou le chlorure de sodium se dissout dans l'eau, il se dissocie en ses ions pour former Na + (aq) et Cl- (aq).

Les substances hydrophobes (craignant l'eau) ne se dissolvent généralement pas dans l'eau et ne forment pas de solutions aqueuses. Par exemple, le mélange d'huile et d'eau n'entraîne pas de dissolution ou de dissociation.
De nombreux composés organiques sont hydrophobes. Les non-électrolytes peuvent se dissoudre dans l'eau, mais ils ne se dissocient pas en ions et conservent leur intégrité en tant que molécules. Des exemples de non-électrolytes comprennent le sucre, le glycérol, l'urée et le méthylsulfonylméthane (MSM).
Propriétés des solutions aqueuses
Les solutions aqueuses conduisent souvent l'électricité. Les solutions contenant des électrolytes forts ont tendance à être de bons conducteurs électriques (par exemple l'eau de mer), tandis que les solutions contenant des électrolytes faibles ont tendance à être de mauvais conducteurs (par exemple l'eau du robinet)..
La raison en est que les électrolytes forts se dissocient complètement en ions dans l'eau, tandis que les électrolytes faibles se dissocient incomplètement..
Lorsque des réactions chimiques entre espèces se produisent dans une solution aqueuse, les réactions sont généralement des réactions de double déplacement (également appelées métathèse ou double substitution)..
Dans ce type de réaction, le cation dans un réactif prend la place du cation dans l'autre réactif, formant typiquement une liaison ionique. Une autre façon d’y penser est que les ions réactifs "changent de partenaires".
Les réactions en solution aqueuse peuvent produire des produits solubles dans l'eau ou peuvent produire un précipité..
Un précipité est un composé à faible solubilité qui tombe souvent hors de la solution sous forme de solide..
Les termes acide, base et pH ne s'appliquent qu'aux solutions aqueuses. Par exemple, vous pouvez mesurer le pH du jus de citron ou du vinaigre (deux solutions aqueuses) et ce sont des acides faibles, mais vous ne pouvez pas obtenir d'informations significatives à partir du test d'huile végétale avec du papier pH..
Pourquoi certains solides se dissolvent-ils dans l'eau?
Le sucre que nous utilisons pour sucrer le café ou le thé est un solide moléculaire, dans lequel les molécules individuelles sont maintenues ensemble par des forces intermoléculaires relativement faibles..
Lorsque le sucre se dissout dans l'eau, les liaisons faibles entre les molécules de saccharose individuelles sont rompues et ces molécules C12H22O11 sont libérées en solution..
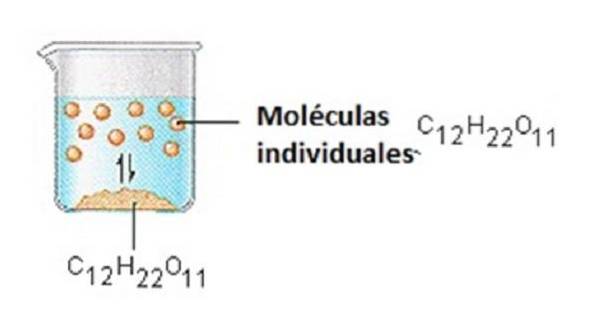
Il faut de l'énergie pour rompre les liaisons entre les molécules C12H22O11 du saccharose. Il faut également de l'énergie pour rompre les liaisons hydrogène dans l'eau qui doivent être rompues pour insérer l'une de ces molécules de saccharose en solution..
Le sucre se dissout dans l'eau car de l'énergie est libérée lorsque des molécules de saccharose légèrement polaires forment des liaisons intermoléculaires avec les molécules d'eau polaires..
Les liaisons faibles qui se forment entre le soluté et le solvant compensent l'énergie nécessaire pour modifier la structure à la fois du soluté pur et du solvant..
Dans le cas du sucre et de l'eau, ce processus fonctionne si bien que jusqu'à 1800 grammes de saccharose peuvent être dissous dans un litre d'eau..
Les solides ioniques (ou sels) contiennent des ions positifs et négatifs, qui sont maintenus ensemble grâce à la grande force d'attraction entre les particules de charges opposées.
Lorsqu'un de ces solides se dissout dans l'eau, les ions qui composent le solide sont libérés en solution, où ils s'associent aux molécules de solvant polaire..
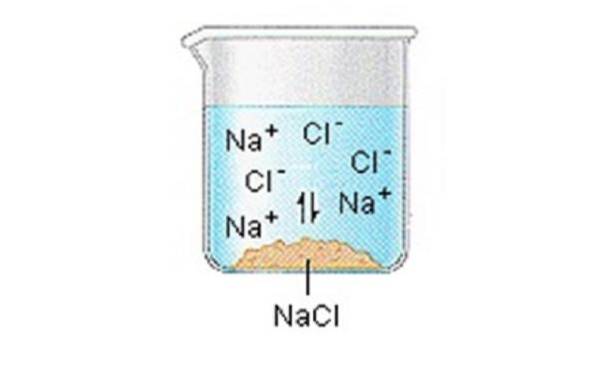
NaCl (s) ”Na + (aq) + Cl- (aq)
On peut généralement supposer que les sels se dissocient en leurs ions lorsqu'ils sont dissous dans l'eau..
Los compuestos iónicos se disuelven en agua si la energía desprendida cuando los iones interactúan con las moléculas de agua compensa la energía necesaria para romper los enlaces iónicos en el sólido y la energía requerida para separar las moléculas de agua para que los iones puedan ser insertados en la solution.
Règles de solubilité
Selon la solubilité d'un soluté, trois résultats sont possibles:
1) Si la solution contient moins de soluté que la quantité maximale qu'elle est capable de dissoudre (sa solubilité), il s'agit d'une solution diluée;
2) Si la quantité de soluté est exactement la même que sa solubilité, il est saturé;
3) S'il y a plus de soluté qu'il ne peut en dissoudre, le soluté en excès se sépare de la solution.
Si ce processus de séparation comprend une cristallisation, il forme un précipité. La précipitation réduit la concentration du soluté à saturation afin d'augmenter la stabilité de la solution..
Voici les règles de solubilité pour les solides ioniques courants. Si deux règles semblent se contredire, la précédente prévaut.
1- Sels contenant des éléments du groupe I (Li+, N / A+, K+, Cs+, Rb+) sont solubles. Il y a quelques exceptions à cette règle. Sels contenant l'ion ammonium (NH4+) sont également solubles.
2- Sels contenant du nitrate (NO3-) sont généralement solubles.
3- Les sels qui contiennent Cl -, Br - ou I - sont généralement solubles. Des exceptions importantes à cette règle sont les sels halogénures d'Ag+, Pb2+ et (Hg2)deux+. Ainsi, AgCl, PbBrdeux et HgdeuxCldeux ils sont insolubles.
4- La plupart des sels d'argent sont insolubles. AgNO3 et Ag (CdeuxH3OU ALORSdeux) sont des sels solubles communs d'argent; Pratiquement tous les autres sont insolubles.
5- La plupart des sels de sulfate sont solubles. Les exceptions importantes à cette règle incluent CaSO4, Baso4, PbSO4, AgdeuxSO4 et SrSO4.
6- La plupart des sels d'hydroxyde ne sont que légèrement solubles. Les sels d'hydroxyde des éléments du groupe I sont solubles. Les sels d'hydroxyde des éléments du groupe II (Ca, Sr et Ba) sont légèrement solubles.
Les sels d'hydroxyde de métaux de transition et d'Al3 + ils sont insolubles. Ainsi, Fe (OH)3, Al (OH)3, Co (OH)deux ils ne sont pas solubles.
7- La plupart des sulfures de métaux de transition sont hautement insolubles, y compris le CdS, le FeS, le ZnS et l'AgdeuxS. L'arsenic, l'antimoine, le bismuth et les sulfures de plomb sont également insolubles.
8- Les carbonates sont souvent insolubles. Carbonates du groupe II (CaCO3, SrCO3 et BaCO3) sont insolubles, tout comme FeCO3 et PbCO3.
9- Les chromates sont souvent insolubles. Les exemples incluent PbCrO4 et BaCrO4.
10- Phosphates tels que Ca3(PO4)deux et Ag3PO4 sont souvent insolubles.
11- Fluorures tels que BaFdeux, MgFdeux et PbFdeux sont souvent insolubles.
Exemples de solubilité dans des solutions aqueuses
Le cola, l'eau salée, la pluie, les solutions acides, les solutions basiques et les solutions salines sont des exemples de solutions aqueuses. Lorsque vous avez une solution aqueuse, vous pouvez induire un précipité par des réactions de précipitation.
Les réactions de précipitation sont parfois appelées réactions de «double déplacement». Pour déterminer si un précipité se forme lorsque des solutions aqueuses de deux composés sont mélangées:
- Enregistrez tous les ions en solution.
- Combinez-les (cation et anion) pour obtenir tous les précipités potentiels.
- Utilisez les règles de solubilité pour déterminer quelle (s) combinaison (s) est (s) insoluble (s) et précipitera.
Exemple 1: Que se passe-t-il lorsque Ba (NON3)deux (aq) et NadeuxCO3 (aq)?
Ions présents en solution: Badeux+, NE PAS3-, N / A+, CO3deux-
Précipités potentiels: BaCO3, NaNO3
Règles de solubilité: BaCO3 est insoluble (règle 5), NaNO3 est soluble (règle 1).
Équation chimique complète:
Bain3)deux(aq) + NadeuxCO3(aq) ”BaCO3(s) + 2NaNO3 (aq)
Équation ionique nette:
Badeux+(aq) + CO3deux-(aq) "BaCO3 (s)
Exemple 2: Que se passe-t-il lorsque Pb (NON3)deux (aq) et NH4Je (aq)?
Ions présents en solution: Pbdeux+, NE PAS3-, NH4+, je-
Précipités potentiels: PbIdeux, NH4NE PAS3
Règles de solubilité: PbIdeux est insoluble (règle 3), NH4NE PAS3 est soluble (règle 1).
Équation chimique complète: Pb (NO3)2 (aq) + 2NH4je(aq) "PbI2 (s) + 2NH4NE PAS3 (aq)
Équation ionique nette: Pbdeux+(aq) + 2I-(aq) "PbI2 (s).
Les références
- Anne Marie Helmenstine. (2017, 10 mai). Définition aqueuse (solution aqueuse). Récupéré de thinkco.com.
- Anne Marie Helmenstine. (2017, 14 mai). Définition de la solution aqueuse en chimie. Récupéré de thinkco.com.
- Antoinette Mursa, K. W. (14 mai 2017). Règles de solubilité. Récupéré de chem.libretexts.org.
- Solutions aqueuses. (S.F.). Récupéré de saylordotorg.github.io.
- Berkey, M. (11 novembre 2011). Solutions aqueuses: définition et exemples. Récupéré de youtube.com.
- Réactions en solution aqueuse. (S.F.). Récupéré de chemistry.bd.psu.edu.
- Reid, D. (S.F.). Solution aqueuse: définition, réaction et exemple. Récupéré de study.com.
- Solubilité. (S.F.). Récupéré de chemed.chem.purdue.edu.



Personne n'a encore commenté ce post.