
Que sont les orbitales dégénérées?
Les orbitales dégénérées ce sont tous ceux qui sont au même niveau d'énergie. Selon cette définition, ils doivent avoir le même nombre quantique principal n. Ainsi, les orbitales 2s et 2p sont dégénérées, puisqu'elles appartiennent au niveau d'énergie 2. Cependant, on sait que leurs fonctions d'onde angulaire et radiale sont différentes.
Comme les valeurs de n, les électrons commencent à occuper d'autres sous-niveaux d'énergie, tels que les orbitales d et f. Chacune de ces orbitales a ses propres caractéristiques, qui à première vue peuvent être vues dans leurs formes angulaires; Ce sont les figures sphérique (s), haltère (p), trèfle (d) et globulaire (f).
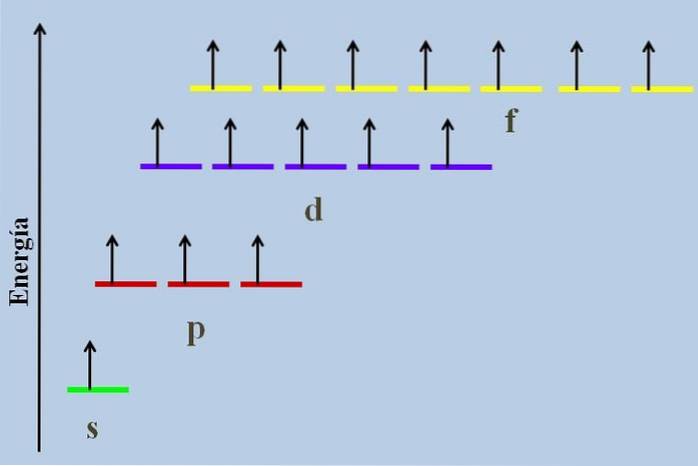
Entre eux, il y a une différence énergétique, même s'ils appartiennent au même niveau n.
Par exemple, l'image ci-dessus montre un schéma énergétique avec les orbitales occupées par des électrons non appariés (un cas anormal). On peut voir que de toutes les plus stables (celle avec l'énergie la plus faible) est l'orbitale ns (1s, 2s, ...), tandis que la nf est la plus instable (celle avec l'énergie la plus élevée).
Index des articles
- 1 Orbitales dégénérées d'un atome isolé
- 1.1 Orbitales p
- 1.2 Orbitales d
- 1.3 Orbitales f
- 2 orbitales hybrides dégénérées
- 3 Références
Orbitales dégénérées d'un atome isolé
Orbitales dégénérées, avec la même valeur de n, ils sont sur la même ligne dans un schéma énergétique. Pour cette raison, les trois bandes rouges qui symbolisent les orbitales p sont situées sur la même ligne; comme le font les rayures violettes et jaunes de la même manière.
Le diagramme de l'image viole la règle de Hund: les orbitales à énergie plus élevée sont remplies d'électrons sans les appairer d'abord dans les orbitales à plus faible énergie. Au fur et à mesure que les électrons s'accouplent, l'orbitale perd de l'énergie et exerce une plus grande répulsion électrostatique sur les électrons non appariés des autres orbitales..
Cependant, de tels effets ne sont pas pris en compte dans de nombreux diagrammes énergétiques. Si tel est le cas, et obéissant à la règle de Hund sans remplir complètement les orbitales d, on verrait qu'elles cessent d'être dégénérées.
Comme mentionné précédemment, chaque orbitale a ses propres caractéristiques. Un atome isolé, avec sa configuration électronique, a ses électrons disposés dans le nombre précis d'orbitales pour les accueillir. Seuls ceux égaux en énergie peuvent être considérés comme dégénérés.
Orbitales p
Les trois bandes rouges pour les orbitales dégénérées p dans l'image indiquent que les deux pX, pOui Et Pz ils possèdent la même énergie. Il y a un électron non apparié dans chacun, décrit par quatre nombres quantiques (n, l, ml Oui Mme), tandis que les trois premiers décrivent les orbitales.
La seule différence entre eux est désignée par le moment magnétique ml, qui trace le chemin de pX sur un axe x, pOui sur l'axe des y, et pz sur l'axe z. Les trois sont identiques, mais ne diffèrent que par leurs orientations spatiales. Pour cette raison, ils sont toujours dessinés alignés en énergie, c'est-à-dire dégénérés.
Puisqu'ils sont identiques, un atome d'azote isolé (avec une configuration 1sdeux2 sdeux2 P3) doit garder ses trois orbitales p dégénérées. Cependant, le scénario énergétique change brusquement si l'on considère un atome N dans une molécule ou un composé chimique..
Parce que? Parce que bien que pX, pOui Et Pz ils sont égaux en énergie, cela peut varier dans chacun d'eux s'ils ont des environnements chimiques différents; c'est-à-dire s'ils se lient à différents atomes.
Orbitales d
Il y a cinq bandes violettes qui indiquent les orbitales d. Dans un atome isolé, même s'ils ont des électrons appariés, ces cinq orbitales sont considérées comme dégénérées. Cependant, contrairement aux orbitales p, il y a cette fois une différence marquée dans leurs formes angulaires.
Par conséquent, ses électrons parcourent des directions dans l'espace qui varient d'une orbitale à une autre. Cela provoque, selon théorie du champ cristallin, qu'une perturbation minimale provoque un partage d'énergie des orbitales; c'est-à-dire que les cinq bandes violettes se séparent, laissant un écart d'énergie entre elles:
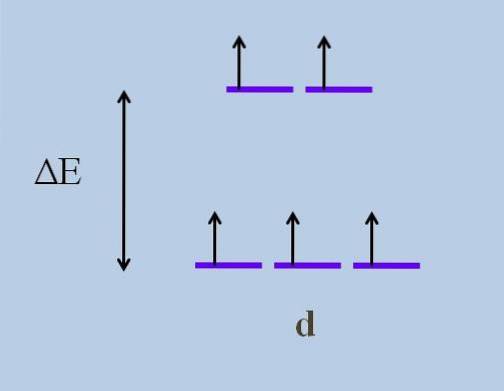
Quelles sont les orbitales supérieures et quelles sont les orbitales inférieures? Ceux ci-dessus sont symbolisés par etg, et ceux ci-dessous t2 g. Notez comment initialement toutes les bandes violettes étaient alignées, et maintenant un ensemble de deux orbitales a été formé etg plus énergique que l'autre ensemble de trois orbitales t2 g.
Cette théorie nous permet d'expliquer les transitions d-d, auxquelles sont attribuées de nombreuses couleurs observées dans les composés des métaux de transition (Cr, Mn, Fe, etc.). Et quelle est la cause de cette perturbation électronique? Aux interactions de coordination du centre métallique avec d'autres molécules appelées ligands.
Orbitales f
Et avec les orbitales f, les bandes jaunes en feutre, la situation devient encore plus compliquée. Leurs directions spatiales varient beaucoup entre eux, et l'affichage de leurs liens devient trop complexe.
En fait, les orbitales f sont considérées comme étant tellement gainées intérieurement qu'elles ne «participent pas de manière appréciable» à la formation des liaisons..
Lorsque l'atome isolé avec des orbitales f s'entoure d'autres atomes, les interactions commencent et le déploiement se produit (perte de dégénérescence):
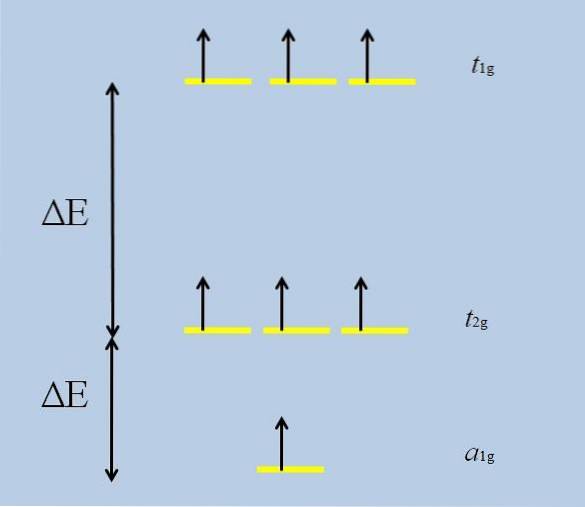
Notez que maintenant les bandes jaunes forment trois ensembles: t1g, t2 g Oui à1g, et qu'ils ne sont plus dégénérés.
Orbitales hybrides dégénérées
On a vu que les orbitales peuvent se déplier et perdre leur dégénérescence. Cependant, bien que cela explique les transitions électroniques, cela ne permet pas d'élucider comment et pourquoi il existe différentes géométries moléculaires. C'est là qu'interviennent les orbitales hybrides..
Quelles sont ses principales caractéristiques? Qu'ils sont dégénérés. Ainsi, ils proviennent du mélange de caractères des orbitales s, p, d et f, pour engendrer des hybrides dégénérés.
Par exemple, trois orbitales p se mélangent à une s pour donner quatre orbitales sp3. Toutes les orbitales SP3 sont dégénérés, et ont donc la même énergie.
Si en outre deux orbitales d sont mélangées avec les quatre sp3, vous obtiendrez six orbitales sp3rédeux.
Et comment expliquent-ils les géométries moléculaires? Comme il y en a six, à énergies égales, ils doivent donc être orientés symétriquement dans l'espace pour générer des environnements chimiques égaux (par exemple, dans un composé MF6).
Quand ils le font, un octaèdre de coordination est formé, qui est égal à une géométrie octaédrique autour d'un centre (M).
Cependant, les géométries sont souvent déformées, ce qui signifie que même les orbitales hybrides ne sont pas vraiment complètement dégénérées. Par conséquent, en guise de conclusion, les orbitales dégénérées n'existent que dans des atomes isolés ou dans des environnements hautement symétriques..
Les références
- Dictionnaire Chemicool. (2017). Défintion dégénérée. Récupéré de: chemicool.com
- SparkNotes LLC. (2018). Atomes et orbitales atomiques. Récupéré de: sparknotes.com
- Chimie pure. (s.f.). Configuration électronique. Récupéré de: es-puraquimica.weebly.com
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Moreno R. Esparza. (2009). Cours de chimie de coordination: Champs et orbitales. [PDF]. Récupéré de: depa.fquim.unam.mx
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.

Personne n'a encore commenté ce post.