
Que sont les sous-niveaux d'énergie et comment sont-ils représentés?

Les sous-niveaux d'énergie dans l'atome, ils sont la manière dont les électrons sont organisés dans les coques électroniques, leur distribution dans la molécule ou l'atome. Ces sous-niveaux d'énergie sont appelés orbitales..
L'organisation des électrons en sous-niveaux est ce qui permet les combinaisons chimiques de différents atomes et définit également leur position dans le tableau périodique des éléments..
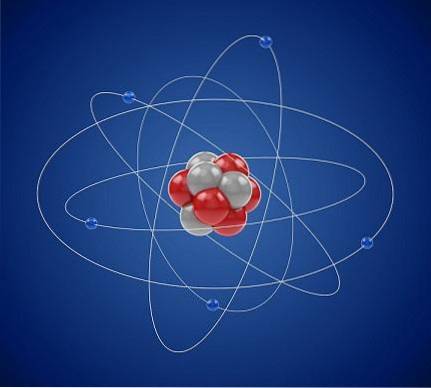
Les électrons sont disposés dans les coquilles électroniques de l'atome d'une certaine manière par une combinaison d'états quantiques. Au moment où l'un de ces états est occupé par un électron, les autres électrons doivent être situés dans un état différent.
Index des articles
- 1. Introduction
- 2 Emplacement dans le tableau périodique des éléments
- 3 Localisation de l'électron dans les orbitales
- 4 Configurations électroniques spéciales
- 5 Références
introduction
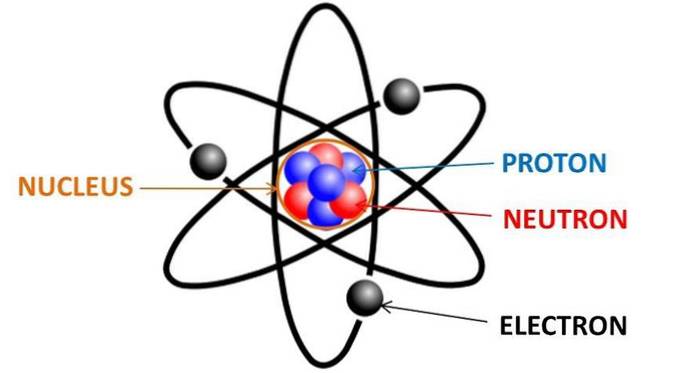
Chaque élément chimique du tableau périodique est constitué d'atomes, qui à leur tour sont constitués de neutrons, de protons et d'électrons. Les électrons sont des particules chargées négativement qui se trouvent autour du noyau de n'importe quel atome, réparties dans les orbitales des électrons.
Les orbitales électroniques sont le volume de l'espace où un électron a 95% de chances de se rencontrer. Il existe différents types d'orbitales, de formes différentes. Un maximum de deux électrons peut être localisé dans chaque orbitale. La première orbitale d'un atome est l'endroit où il y a la plus grande probabilité de trouver des électrons.
Les orbitales sont désignées par les lettres s, p, d et f, c'est-à-dire Sharp, Principe, Diffuse et Fundamental, et elles se combinent lorsque les atomes se réunissent pour former une molécule plus grande. Dans chaque couche de l'atome se trouvent ces combinaisons d'orbitales.
Par exemple, dans la couche 1 de l'atome il y a les orbitales S, dans la couche 2 il y a les orbitales S et P, dans la couche 3 de l'atome il y a les orbitales S, P et D et enfin dans la couche 4 de l'atome il y a toutes les orbitales S, P, D et F.
Également dans les orbitales, nous trouvons différents sous-niveaux, qui à leur tour peuvent stocker plus d'électrons. Les orbitales à différents niveaux d'énergie sont similaires les unes aux autres, mais occupent différentes zones dans l'espace..
La première orbitale et la deuxième orbitale ont les mêmes caractéristiques qu'une orbitale S, elles ont des nœuds radiaux, elles ont une plus grande probabilité de volume sphérique et elles ne peuvent contenir que deux électrons. Cependant, ils sont situés à des niveaux d'énergie différents et occupent ainsi différents espaces autour du noyau..
Emplacement sur le tableau périodique des éléments
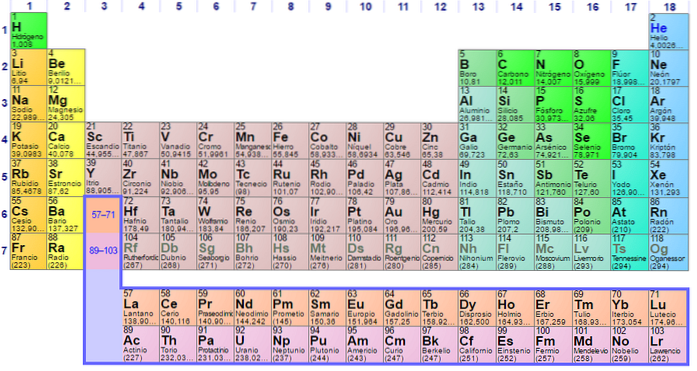
Chacune des configurations électroniques des éléments est unique, c'est pourquoi elles déterminent leur position dans le tableau périodique des éléments. Cette position est définie par la période de chaque élément et son numéro atomique par le nombre d'électrons que possède l'atome de l'élément..
Ainsi, l'utilisation du tableau périodique pour déterminer la configuration des électrons dans les atomes est essentielle. Les éléments sont répartis en groupes selon leurs configurations électroniques comme suit:
Chaque orbitale est représentée dans des blocs spécifiques dans le tableau périodique des éléments. Par exemple, le bloc des orbitales S est la région des métaux alcalins, le premier groupe du tableau et où se trouvent six éléments Lithium (Li), Rubidium (Rb), Potassium (K), Sodium (Na), Francium ( Fr) et du césium (Cs) et aussi de l'hydrogène (H), qui n'est pas un métal, mais un gaz.
Ce groupe d'éléments a un électron, qui se perd facilement pour former un ion chargé positivement. Ce sont les métaux les plus actifs et les plus réactifs.
L'hydrogène, dans ce cas, est un gaz, mais il fait partie du groupe 1 du tableau périodique des éléments car il n'a également qu'un seul électron. L'hydrogène peut former des ions avec une seule charge positive, mais retirer son seul électron nécessite beaucoup plus d'énergie que d'éliminer les électrons des autres métaux alcalins. Lors de la formation de composés, l'hydrogène génère généralement des liaisons covalentes.
Cependant, sous des pressions extrêmement élevées, l'hydrogène devient métallique et se comporte comme le reste des éléments de son groupe. Cela se produit, par exemple, à l'intérieur du noyau de la planète Jupiter.
Le groupe 2 correspond aux métaux alcalino-terreux, car leurs oxydes ont des propriétés alcalines. Parmi les éléments de ce groupe, on trouve le magnésium (Mg) et le calcium (Ca). Leurs orbitales appartiennent également au niveau S.
Les métaux de transition, qui correspondent aux groupes 3 à 12 dans le tableau périodique, ont des orbitales de type D..
Les éléments qui vont du groupe 13 à 18 dans le tableau correspondent aux orbitales P. Et enfin les éléments appelés lanthanides et actinides ont des orbitales nommées F.
Localisation des électrons dans les orbitales
Les électrons se trouvent dans les orbitales de l'atome comme moyen d'abaisser l'énergie. Par conséquent, s'ils cherchent à augmenter l'énergie, les électrons rempliront les principaux niveaux orbitaux, s'éloignant du noyau de l'atome..
Il faut considérer que les électrons ont une propriété intrinsèque appelée spin. Il s'agit d'un concept quantique qui détermine, entre autres, le spin de l'électron dans l'orbitale. Ce qui est essentiel pour déterminer votre position dans les sous-niveaux d'énergie.
Les règles qui déterminent la position des électrons dans les orbitales de l'atome sont les suivantes:
- Principe d'Aufbau: Les électrons entrent en premier dans les orbitales de plus faible énergie. Ce principe est basé sur des schémas des niveaux d'énergie de certains atomes.
- Principe d'exclusion de Pauli: Une orbitale atomique peut décrire au moins deux électrons. Cela signifie que seuls deux électrons avec un spin électronique différent peuvent occuper une orbitale atomique..
Cela implique qu'une orbitale atomique est un état énergétique.
- Règle de Hund: lorsque les électrons occupent des orbitales de même énergie, les électrons entreront dans les premières orbitales vides. Cela signifie que les électrons préfèrent les spins parallèles sur des orbites séparées des sous-niveaux d'énergie..
Les électrons rempliront toutes les orbitales des sous-niveaux avant de rencontrer des spins opposés.
Configurations électroniques spéciales
Il existe également des atomes avec des cas particuliers de sous-niveaux d'énergie. Lorsque deux électrons occupent la même orbitale, non seulement doivent-ils avoir des spins différents (comme indiqué par le principe d'exclusion de Pauli), mais le couplage des électrons augmente légèrement l'énergie..
Dans le cas des sous-niveaux d'énergie, un sous-niveau à moitié plein et un sous-niveau plein réduit l'énergie de l'atome. Cela conduit l'atome à avoir une plus grande stabilité.
Les références
- Configuration électronique. Récupéré de Wikipedia.com.
- Introduction aux configurations électroniques. Récupéré de chem.libretexts.org.
- Orbitales et obligations. Récupéré de chem.fsu.edu.
- Tableau périodique, principaux éléments du groupe. Récupéré de newworldencyclopedia.org.
- Principes de configuration électro. Récupéré de sartep.com.
- Configuration électronique des éléments. Récupéré de science.uwaterloo.ca.
- Spin électronique. Récupéré de hyperphysics.phy-astr.gsu.edu.


Personne n'a encore commenté ce post.