
Découverte des rayons anodiques, propriétés

Les rayons d'anode ou rayons de canal, Aussi appelés positifs, ce sont des faisceaux de rayons positifs constitués de cations atomiques ou moléculaires (ions chargés positivement) qui sont dirigés vers l'électrode négative dans un tube de Crookes..
Les rayons anodiques proviennent lorsque les électrons qui vont de la cathode vers l'anode, entrent en collision avec les atomes du gaz enfermé dans le tube de Crookes.

Au fur et à mesure que les particules de même signe se repoussent, les électrons allant vers l'anode arrachent les électrons présents dans la croûte des atomes de gaz..
Ainsi, les atomes qui sont restés chargés positivement - c'est-à-dire qu'ils ont été transformés en ions positifs (cations) - sont attirés vers la cathode (chargés négativement).
Index des articles
- 1 Découverte
- 2 propriétés
- 3 Un peu d'histoire
- 3.1 Le tube à rayons anodiques
- 3.2 Le proton
- 3.3 Spectrométrie de masse
- 4 Références
Découverte
C'est le physicien allemand Eugen Goldstein qui les a découverts, les observant pour la première fois en 1886.
Par la suite, les travaux menés sur les rayons anodiques par les scientifiques Wilhelm Wien et Joseph John Thomson ont fini par supposer le développement de la spectrométrie de masse..
Propriétés
Les principales propriétés des rayons anodiques sont les suivantes:
- Ils ont une charge positive, la valeur de leur charge étant un multiple entier de la charge de l'électron (1,6 ∙ 10-19 C).
- Ils se déplacent en ligne droite en l'absence de champs électriques et de champs magnétiques.
- Ils s'écartent en présence de champs électriques et de champs magnétiques, se déplaçant vers la zone négative.
- Peut pénétrer de fines couches de métaux.
- Ils peuvent ioniser les gaz.
- La masse et la charge des particules qui composent les rayons anodiques varient en fonction du gaz enfermé dans le tube. Normalement, leur masse est identique à la masse des atomes ou molécules dont ils sont issus..
- Ils peuvent provoquer des changements physiques et chimiques.
Un peu d'histoire
Avant la découverte des rayons anodiques, la découverte des rayons cathodiques a eu lieu, qui a eu lieu tout au long des années 1858 et 1859. La découverte est due à Julius Plücker, un mathématicien et physicien d'origine allemande..
Plus tard, c'est le physicien anglais Joseph John Thomson qui a étudié en profondeur le comportement, les caractéristiques et les effets des rayons cathodiques..
De son côté, Eugen Goldstein - qui avait auparavant mené d'autres recherches avec les rayons cathodiques - est celui qui a découvert les rayons anodiques. La découverte a eu lieu en 1886 et il l'a fait quand il s'est rendu compte que les tubes à décharge avec la cathode perforée émettaient également de la lumière à l'extrémité de la cathode..
Il découvrit ainsi qu'en plus des rayons cathodiques, il y avait d'autres rayons: les rayons anodiques; ceux-ci allaient dans la direction opposée. Puisque ces rayons traversaient les trous ou les canaux de la cathode, il a décidé de les appeler rayons de canal..
Cependant, ce n'est pas lui mais Wilhelm Wien qui a ensuite fait des études approfondies sur les rayons anodiques. Wien, avec Joseph John Thomson, a fini par jeter les bases de la spectrométrie de masse.
La découverte d'Eugen Goldstein sur les rayons anodiques a constitué un pilier fondamental pour le développement ultérieur de la physique contemporaine..
Grâce à la découverte des rayons anodiques, des essaims d'atomes en mouvement rapide et ordonné sont devenus disponibles pour la première fois, dont l'application était très fertile pour différentes branches de la physique atomique..
Le tube à rayons anodiques
Lors de la découverte des rayons anodiques, Goldstein a utilisé un tube à décharge dont la cathode était perforée. Le processus détaillé par lequel les rayons anodiques sont formés dans un tube à décharge de gaz est le suivant.
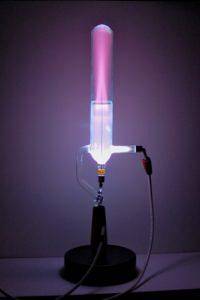
En appliquant une grande différence de potentiel de plusieurs milliers de volts au tube, le champ électrique qui est créé accélère le petit nombre d'ions qui sont toujours présents dans un gaz et qui sont créés par des processus naturels tels que la radioactivité..
Ces ions accélérés entrent en collision avec les atomes du gaz, en arrachant les électrons et en créant plus d'ions positifs. À leur tour, ces ions et électrons attaquent à nouveau plus d'atomes, créant plus d'ions positifs dans ce qui est une réaction en chaîne..
Les ions positifs sont attirés par la cathode négative et certains passent à travers des trous de la cathode. Au moment où ils atteignent la cathode, ils ont déjà accéléré assez rapidement pour que lorsqu'ils entrent en collision avec d'autres atomes et molécules du gaz, ils excitent l'espèce à des niveaux d'énergie plus élevés..
Lorsque ces espèces reviennent à leurs niveaux d'énergie d'origine, les atomes et les molécules libèrent l'énergie qu'ils avaient précédemment acquise; l'énergie est émise sous forme de lumière.
Ce processus de production de lumière, appelé fluorescence, fait apparaître une lueur dans la région où les ions émergent de la cathode.
Le proton
Bien que Goldstein ait obtenu des protons avec ses expériences avec des rayons anodiques, la vérité est qu'il n'est pas celui qui est crédité de la découverte du proton, car il n'a pas été en mesure de l'identifier correctement..
Le proton est la plus légère des particules positives produites dans les tubes à rayons anodiques. Le proton est produit lorsque le tube est chargé d'hydrogène gazeux. De cette manière, lorsque l'hydrogène s'ionise et perd son électron, des protons sont obtenus..
Le proton a une masse de 1,67 ∙ 10-24 g, presque le même que celui de l'atome d'hydrogène, et a la même charge mais avec le signe opposé à celui de l'électron; c'est-à-dire 1,6 ∙ 10-19 C.
Spectrométrie de masse
La spectrométrie de masse, développée à partir de la découverte des rayons anodiques, est une procédure analytique qui permet d'étudier la composition chimique des molécules d'une substance en fonction de leur masse..
Il permet à la fois de reconnaître des composés inconnus, de dénombrer les composés connus, ainsi que de connaître les propriétés et la structure des molécules d'une substance.
De son côté, le spectromètre de masse est un appareil permettant d'analyser de manière très précise la structure de différents composés chimiques et isotopes..
Le spectromètre de masse permet la séparation des noyaux atomiques en fonction de la relation entre la masse et la charge.

Les références
-
- Rayon anodique (n.d.). Sur Wikipedia. Récupéré le 19 avril 2018 sur es.wikipedia.org.
- Rayon anodique (n.d.). Sur Wikipedia. Récupéré le 19 avril 2018 sur en.wikipedia.org.
- Spectromètre de masse (n.d.). Sur Wikipedia. Récupéré le 19 avril 2018 sur es.wikipedia.org.
- Grayson, Michael A. (2002). Mesurer la masse: des rayons positifs aux protéines. Philadelphie: Chemical Heritage Press
- Grayson, Michael A. (2002). Mesurer la masse: des rayons positifs aux protéines. Philadelphie: Chemical Heritage Press.
- Thomson, J. J. (1921). Rayons d'électricité positive et leur application aux analyses chimiques (1921)
- Fidalgo Sánchez, José Antonio (2005). Physique et chimie. Everest



Personne n'a encore commenté ce post.