
Réactions et exemples de déplacement simple et double
le réactions de déplacement sont tous ceux dans lesquels une espèce chimique en déplace une autre au sein d'un composé. Ce déplacement peut être simple ou double, différant en ce que dans le premier c'est un élément qui se déplace, tandis que dans le second il y a un changement de «paires» entre deux composés..
Ces types de réactions ne sont possibles que sous certaines conditions: l'une des espèces doit avoir un indice d'oxydation nul ou toutes doivent nécessairement être ionisées. Que signifie un nombre d'oxydation égal à zéro? Cela signifie que l'espèce est dans son état naturel.

Un exemple très illustratif de l'approche ci-dessus est la réaction entre un fil de cuivre et une solution de nitrate d'argent. Puisque le cuivre est un métal à son état naturel, son indice d'oxydation est zéro; par contre, celui de l'argent est +1 (Ag+), qui se dissout avec les ions nitrate (NO3-).
Les métaux abandonnent des électrons, mais certains sont plus actifs que d'autres; Cela signifie que tous les métaux ne rouillent pas aussi facilement. Parce que le cuivre est plus actif que l'argent, il donne ses électrons, le réduisant à son état naturel, reflété comme une surface d'argent qui recouvre le fil de cuivre (image ci-dessus).
Index des articles
- 1 Réactions de déplacement
- 1.1 Simple
- 1.2 Double
- 2 exemples
- 2.1 Simple
- 2,2 Double
- 3 Références
Réactions de déplacement
Simple
Déplacement d'hydrogène et de métaux
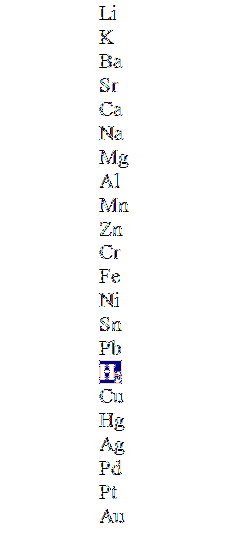
L'image du haut montre une colonne par ordre décroissant d'activité, mettant en évidence la molécule d'hydrogène. Les métaux qui sont au-dessus peuvent le déplacer dans les acides non oxydants (HCl, HF, HdeuxSW4, etc.), et ceux ci-dessous ne réagiront pas du tout.
La réaction de déplacement simple peut être décrite par l'équation générale suivante:
A + BC => AB + C
A déplace C, qui peut être la molécule Hdeux ou autre métal. Oui Hdeux est formé par la réduction des ions H+ (2H+ + 2e- => Hdeux), alors l'espèce A doit - en raison de la conservation de la masse et de l'énergie - fournir les électrons: elle doit être oxydée.
En revanche, si A et C sont des espèces métalliques, mais C est sous forme ionique (M+) et A dans son état naturel, alors la réaction de déplacement ne se produira que si A est plus actif que C, forçant ce dernier à accepter des électrons pour se réduire à son état métallique (M).
Déplacement avec des halogènes
De la même manière, les halogènes (F, Cl, Br, I, At) peuvent se déplacer les uns avec les autres mais en suivant une autre série d'activités. Pour ceux-ci, l'activité diminue à mesure que l'on descend dans le groupe 7A (ou 17): I Par exemple, la réaction suivante se produit naturellement: Fdeux(g) + 2NaI (ac) => 2NaF (ac) + Ideux(s) Cependant, cet autre ne produit aucun produit pour les raisons qui viennent d'être expliquées: jedeux(s) + NaF (ac) => X Dans l'équation ci-dessus, X signifie qu'il n'y a pas de réaction. Avec cette connaissance, on peut prédire quel mélange de sels halogènes avec les éléments purs produit des produits. En règle générale, l'iode (un solide violet volatil) ne déplace aucun des autres halogènes, mais les autres le déplacent lorsqu'il est sous forme ionique (Na+ je-). La réaction de double déplacement, également appelée réaction de métathèse, est représentée comme suit: AB + CD => AD + CB Cette fois, non seulement A déplace C, mais aussi B déplace D. Ce type de déplacement ne se produit que lorsque des solutions de sels solubles sont mélangées et qu'un précipité se forme; c'est-à-dire que l'AD ou le CB doit être insoluble et avoir de fortes interactions électrostatiques. Par exemple, lors du mélange de solutions KBr et AgNO3, les quatre ions se déplacent à travers le milieu jusqu'à ce qu'ils forment les paires correspondantes de l'équation: KBr (ac) + AgNO3(ac) => AgBr (s) + KNO3(ac) Ions Ag+ et Br- forment le précipité de bromure d'argent, tandis que K+ et non3- ne peut pas être arrangé pour former un cristal de nitrate de potassium. Lorsqu'un acide est neutralisé avec une base, une réaction de double déplacement se produit: HCl (aq) + NaOH (aq) => NaCl (aq) + HdeuxO (l) Ici, aucun précipité ne se forme, car le chlorure de sodium est un sel très soluble dans l'eau, mais un changement de pH se produit, qui s'ajuste à une valeur proche de 7. Cependant, dans la réaction suivante, un changement de pH et la formation d'un précipité se produisent simultanément: H3PO4(ac) + 3Ca (OH)deux => Ca3(PO4)deux(s) + 3HdeuxO (l) Le phosphate de calcium est insoluble, précipitant sous forme de solide blanc, tandis que l'acide phosphorique est neutralisé avec de l'hydroxyde de calcium. Cu (s) + 2AgNO3(ac) => Cu (NON3)deux(ac) + 2Ag (s) C'est la réaction d'image du fil de cuivre. Si vous regardez la série d'activités chimiques pour les métaux, vous constaterez que le cuivre est au-dessus de l'argent, donc il peut le déplacer.. Zn (s) + CuSO4(ac) => ZnSO4(ac) + Cu (s) Avec cette autre réaction, le contraire se produit: maintenant la solution bleuâtre de CuSO4 devient transparent lorsque le cuivre précipite sous forme de métal et en même temps le zinc métallique se désintègre en sel de sulfate de zinc soluble. 2Al (s) + 3NiBrdeux(ac) => 2AlBr3(ac) + 3Ni (s) Encore une fois, cette réaction se produit parce que l'aluminium est au-dessus du nickel dans la série d'activités chimiques. Sn (s) + HdeuxSW4(ac) => SnSO4(ac) + Hdeux(g) Ici, l'étain déplace l'hydrogène, bien qu'il en soit très proche dans la série. 2K (s) + 2HdeuxO (l) => 2KOH (aq) + Hdeux(g) Enfin, les métaux qui sont dans la partie la plus élevée de la série sont si réactifs qu'ils déplacent même l'hydrogène dans les molécules d'eau, générant une réaction très exothermique (et explosive).. Zn (NON3)deux(aq) + 2NaOH (aq) => Zn (OH)deux(s) + 2NaNO3(ac) Bien que la base ne neutralise aucun acide, les ions OH- ressentez plus d'affinité pour Zndeux+ que les ions ne sont PAS3-; pour cette raison, le double déplacement se produit. Timbre3)deux(ac) + NadeuxS (ac) => CuS (s) + 2NaNO3(ac) Cette réaction est très similaire à la précédente, à la différence que les deux composés sont des sels dissous dans l'eau..Double
Réaction de neutralisation acide-base
Exemples
Simple
Double
Les références



Personne n'a encore commenté ce post.