
Histoire du sélénium, propriétés, structure, obtention, utilisations
le sélénium C'est un élément chimique non métallique qui appartient au groupe 16 du tableau périodique et est représenté par le symbole Se. Cet élément a des propriétés intermédiaires entre le soufre et le tellure, qui sont membres du même groupe.
Le sélénium a été découvert en 1817 par Jöhs J. Berzelius et John G. Gahn, qui, lors de la vaporisation de la pyrite, ont observé un résidu rouge (image du bas). Au début, ils l'ont confondu avec le tellure, mais ensuite ils ont réalisé qu'il s'agissait d'un nouvel élément.

Berzelius a nommé le nouvel élément sélénium, basé sur le nom «sélène» qui signifie «déesse de la lune». Le sélénium est un oligo-élément essentiel pour les plantes et les animaux, bien qu'à des concentrations élevées, il soit un élément toxique.
Le sélénium a trois formes allotropes principales: rouge, noir et gris. Ce dernier a la propriété de modifier sa conductance électrique en fonction de l'intensité de la lumière qui l'irradie (photoconducteur), pour lequel il a eu de nombreuses applications.
Le sélénium est largement distribué dans la croûte terrestre, mais les minéraux qui le contiennent ne sont pas abondants, il n'y a donc pas d'extraction de sélénium.
Il est principalement obtenu en tant que sous-produit du processus de raffinage par électrolyse du cuivre. Le sélénium s'accumule dans le limon trouvé à l'anode des cellules d'électrolyse.
Les êtres humains possèdent environ 25 sélénoprotéines, dont certaines ont une action antioxydante et contrôlent la génération de radicaux libres. En outre, il existe des acides aminés du sélénium, tels que la sélénométhionine et la sélénocystéine.
Index des articles
- 1 Histoire
- 1.1 Première observation
- 1.2 Découverte
- 1.3 Origine de son nom
- 1.4 Développer vos applications
- 2 Propriétés physiques et chimiques
- 2.1 Apparence
- 2.2 Poids atomique standard
- 2.3 Numéro atomique (Z)
- 2.4 Point de fusion
- 2.5 Point d'ébullition
- 2.6 Densité
- 2.7 Chaleur de fusion
- 2.8 Chaleur de vaporisation
- 2.9 Capacité thermique molaire
- 2.10 nombres d'oxydation
- 2.11 Electronégativité
- 2.12 Énergie d'ionisation
- 2.13 Ordre magnétique
- 2.14 Dureté
- 2.15 Isotopes
- 2.16 Allotropie
- 3 Réactivité
- 3.1 Réaction avec l'hydrogène
- 3.2 Réaction avec l'oxygène
- 3.3 Réaction avec les halogènes
- 3.4 Réaction avec les métaux
- 3.5 Sélénites
- 3.6 Acides
- 4 Structure et configuration électronique
- 4.1 - Sélénium et ses liaisons
- 4.2 - Anneaux ou chaînes
- 4.3 - Allotropes
- 5 Où trouver et produire
- 5.1 Electrolyse du cuivre
- 6 Rôle biologique
- 6.1 Carence
- 6.2 Cofacteur enzymatique
- 6.3 Protéines et acides aminés
- 7 risques
- 8 utilisations
- 8.1 Cosmétiques
- 8.2 Médecins
- 8.3 Electrolyse du manganèse
- 8.4 Pigment
- 8.5 Photoconducteur
- 8.6 Cristaux
- 8.7 Vulcanisation
- 8.8 Alliages
- 8.9 Redresseurs
- 9 Références
Histoire
Première observation
L'alchimiste Arnold de Villanova a peut-être observé du sélénium en 1230. Il s'est formé à la médecine à la Sorbonne à Paris, et a même été le médecin du pape Clément V.
Villanova dans son livre Rosarium Philosophorum décrit un soufre rouge ou "soufre rebeum" qui avait été laissé dans un four après avoir vaporisé le soufre. Ce soufre rouge peut avoir été un allotrope de sélénium.
Découverte
En 1817, Jöhs Jakob Berzelius et John Gottlieb Gahn ont découvert du sélénium dans une usine chimique pour la production d'acide sulfurique, près de Gripsholm, en Suède. La matière première pour fabriquer l'acide était la pyrite, qui était extraite d'une mine de Falun..
Berzelius a été frappé par l'existence d'un résidu rouge qui est resté dans le conteneur de plomb après que le soufre ait été brûlé.
De plus, Berzelius et Gahn ont observé que le résidu rouge avait une forte odeur de raifort, semblable à celle du tellure. C'est pourquoi, il a écrit à son ami Marect qu'ils croyaient que le gisement observé était un composé de tellure..
Cependant, Berselius a continué à analyser le matériel déposé lorsque la pyrite était incinérée et a reconsidéré qu'aucun tellure n'avait été trouvé dans la mine de Falun. Il a conclu en février 1818 qu'il avait découvert un nouvel élément.
Origine de son nom
Berzelius a souligné que le nouvel élément était une combinaison de soufre et de tellure, et que la similitude du tellure avec le nouvel élément lui avait donné l'occasion de nommer la nouvelle substance sélénium..
Berzelius a expliqué que "tellus" signifie déesse de la terre. Martin Klaport en 1799 a donné ce nom au tellure et a écrit: «Aucun élément ne s'appelle ainsi. Il devait être fait! ".
En raison de la similitude du tellure avec la nouvelle substance, Berzelius l'a nommé avec le mot sélénium, dérivé du mot grec «sélène» qui signifie «déesse de la lune»..
Développement de vos applications
En 1873, Willoughby Smith découvrit que la conductivité électrique du sélénium dépendait de la lumière qui le rayonnait. Cette propriété a permis au sélénium d'avoir de nombreuses applications.
Alexander Graham Bell en 1979 a utilisé du sélénium dans son photophone. Le sélénium produit un courant électrique proportionnel à l'intensité de la lumière qui l'illumine, étant utilisé dans les photomètres, les mécanismes de sécurité pour l'ouverture et la fermeture des portes, etc..
L'utilisation des redresseurs de sélénium dans l'électronique a commencé dans les années 1930, avec de nombreuses applications commerciales. Dans les années 1970, il a été remplacé dans les redresseurs par le silicium.
En 1957, il a été découvert que le sélénium était un élément essentiel pour la vie des mammifères, car il était présent dans les enzymes qui protègent de l'oxygène réactif et des radicaux libres. De plus, l'existence d'acides aminés tels que la sélénométhionine a été découverte.
Proprietes physiques et chimiques
Apparence
Comme il existe plusieurs allotropes pour le sélénium, son apparence physique varie. Se présente généralement sous forme de solide rougeâtre sous forme de poudre.
Poids atomique standard
78.971 u
Numéro atomique (Z)
3. 4
Point de fusion
221 ºC
Point d'ébullition
685 ºC
Densité
La densité du sélénium varie en fonction de l'allotrope ou du polymorphe considéré. Certaines de ses densités déterminées à température ambiante sont:
Gris: 4,819 g / cm3
Alpha: 4,39 g / cm3
Vitreux: 4,28 g / cm3
État liquide (point de fusion): 3,99 g / cm3
Température de fusion
Gris: 6,69 kJ / mol
Chaleur de vaporisation
95,48 kJ / mol
Capacité thermique molaire
25,363 J / (mol K)
Numéros d'oxydation
Le sélénium peut se lier dans ses composés manifestant les nombres ou états d'oxydation suivants: -2, -1, +1, +2, +3, +4, +5, +6. Parmi tous, les plus importants sont -2 (Sedeux-), +4 (Se4+) et +6 (Se6+).
Par exemple, dans le SeOdeux le sélénium a un indice d'oxydation de +4; c'est-à-dire que l'existence du cation Se est supposée4+ (Je connais4+OU ALORSdeuxdeux-). De même avec SeO3 le sélénium a un indice d'oxydation de +6 (Se6+OU ALORS3deux-).
Dans le séléniure d'hydrogène, HdeuxSe, le sélénium a un indice d'oxydation de -2; c'est-à-dire, encore une fois, l'existence de l'ion ou de l'anion Se est supposéedeux- (Hdeux+je connaisdeux-). Il en est ainsi parce que le sélénium est plus électronégatif que l'hydrogène..
Électronégativité
2,55 sur l'échelle de Pauling.
Énergie d'ionisation
-Premier: 941 kJ / mol.
-Deuxième: 2045 kJ / mol.
-Troisième: 2973,7 kJ / mol.
Ordre magnétique
Diamagnétique.
Dureté
2.0 sur l'échelle de Mohs.
Les isotopes
Il existe cinq isotopes naturels et stables du sélénium, qui sont présentés ci-dessous avec leurs abondances respectives:
-74Se (0,86%)
-76Se (9,23%)
-77Se (7,6%)
-78Se (23,69%)
-80Se (49,8%)
Allotropie

Le sélénium préparé dans des réactions chimiques est une poudre amorphe rouge brique qui, une fois fondue rapidement, donne la forme noire vitreuse, semblable aux perles de chapelet (image du haut). Le sélénium noir est un solide cassant et brillant.
De plus, le sélénium noir est légèrement soluble dans le sulfure de carbone. Lorsque cette solution est chauffée à 180 ºC, le sélénium gris précipite, son allotrope le plus stable et le plus dense..
Le sélénium gris est résistant à l'oxydation et est inerte à l'action des acides non oxydants. La propriété principale de ce sélénium est sa photoconductivité. Lorsqu'il est allumé, sa conductivité électrique augmente d'un facteur 10 à 15 fois.
Réactivité
Le sélénium dans ses composés existe dans les états d'oxydation -2, +4 et +6. Il montre une nette tendance à former des acides dans les états d'oxydation supérieurs. Les composés qui contiennent du sélénium à l'état d'oxydation -2 sont appelés séléniures (Sedeux-).
Réaction avec l'hydrogène
Le sélénium réagit avec l'hydrogène pour former du séléniure d'hydrogène (HdeuxSe), un gaz incolore, inflammable et malodorant.
Réaction avec l'oxygène
Le sélénium brûle en émettant une flamme bleue et en formant du dioxyde de sélénium:
je connais8 (s) + 8 Odeux => 8 SeOdeux (s)
L'oxyde de sélénium est une substance polymère solide et blanche. Son hydratation produit de l'acide sélénieux (HdeuxSeO3). Le sélénium forme également du trioxyde de sélénium (SeO3), analogue au soufre (SO3).
Réaction avec les halogènes
Le sélénium réagit avec le fluor pour former de l'hexafluorure de sélénium:
je connais8 (s) + 24 Fdeux (g) => 8 SeF6 (l)
Le sélénium réagit avec le chlore et le brome pour former respectivement du dichlorure et du dibromure de disilénium:
je connais8 (s) + 4 Cldeux => 4 SedeuxCldeux
je connais8 (s) + 4 Brdeux => 4 SedeuxBrdeux
Le sélénium peut également former SeF4 et SeCl4.
D'autre part, le sélénium forme des composés dans lesquels un atome de sélénium se joint à l'un d'halogène et à un autre d'oxygène. Un exemple important est l'oxychlorure de sélénium (SeOdeuxCldeux), avec du sélénium à l'état d'oxydation +6, un solvant extrêmement puissant.
Réaction avec les métaux
Le sélénium réagit avec les métaux pour former des séléniures d'aluminium, de cadmium et de sodium. L'équation chimique ci-dessous correspond à celle de la formation du séléniure d'aluminium:
3 Se8 + 16 Al => 8 Aldeuxje connais3
Sélénites
Le sélénium forme des sels connus sous le nom de sélénites; par exemple: sélénite d'argent (AgdeuxSeO3) et le sélénite de sodium (NadeuxSeO3). Ce nom a été utilisé, dans un contexte littéraire, pour désigner les habitants de la Lune: les Sélénites.
Acides
L'acide le plus important du sélénium est l'acide sélénique (HdeuxSeO4). Il est aussi fort que l'acide sulfurique et se réduit plus facilement.
Structure et configuration électronique
- Sélénium et ses liens
Le sélénium a six électrons de valence, c'est pourquoi il est situé dans le groupe 16, le même que l'oxygène et le soufre. Ces six électrons sont dans les orbitales 4s et 4p, selon leur configuration électronique:
[Ar] 3ddix 4 sdeux 4p4
Il a donc besoin, comme le soufre, de former deux liaisons covalentes pour compléter son octet de valence; bien qu'il ait la disponibilité de ses orbitales 4d pour se lier à plus de deux atomes. Ainsi, trois atomes de sélénium se rejoignent et forment deux liaisons covalentes: Se-Se-Se.
Le sélénium avec sa masse atomique la plus élevée a une tendance naturelle à former des structures gouvernées par des liaisons covalentes; au lieu d'être disposés en molécules diatomiques Sedeux, Se = Se, analogue à Odeux, O = O.
- Anneaux ou chaînes
Parmi les structures moléculaires que les atomes de sélénium adoptent, deux peuvent être citées en termes généraux: les cycles ou les chaînes. Notez que dans le cas hypothétique de Se3, les atomes de Se aux extrémités nécessitent encore des électrons; par conséquent, ils doivent être liés à d'autres atomes, successivement, jusqu'à ce que la chaîne puisse être fermée en un cycle.
Les cycles les plus courants sont les cycles à huit chaînons ou les atomes de sélénium:8 (une couronne de sélénite). Pourquoi huit? Parce que plus l'anneau est petit, plus il subira de stress; c'est-à-dire que les angles de leurs liaisons s'écartent des valeurs naturelles fixées par leurs hybridations sp3 (similaire à celui des cycloalcanes).
Comme il y a huit atomes, la séparation entre les atomes de Se-Se est suffisante pour que leurs liaisons soient «relâchées» et non «pliées»; bien que l'angle de ses maillons soit de 105,7 ° et non de 109,5 °. D'autre part, il peut y avoir des anneaux plus petits:6 et se7.
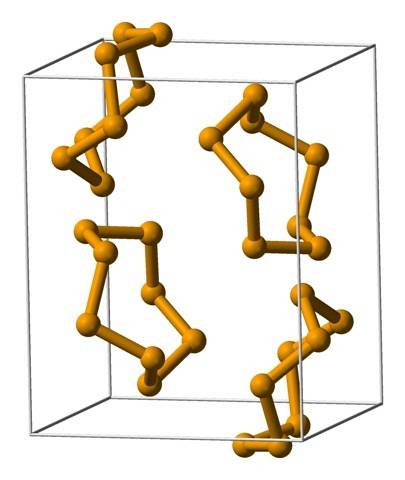
L'image du haut montre les unités de l'anneau Se.8. Notez la ressemblance qu'ils ont avec les couronnes de soufre; seulement ils sont plus gros et plus lourds.
En plus des anneaux, les atomes de sélénium peuvent également être disposés en chaînes hélicoïdales (pensez aux escaliers en colimaçon):
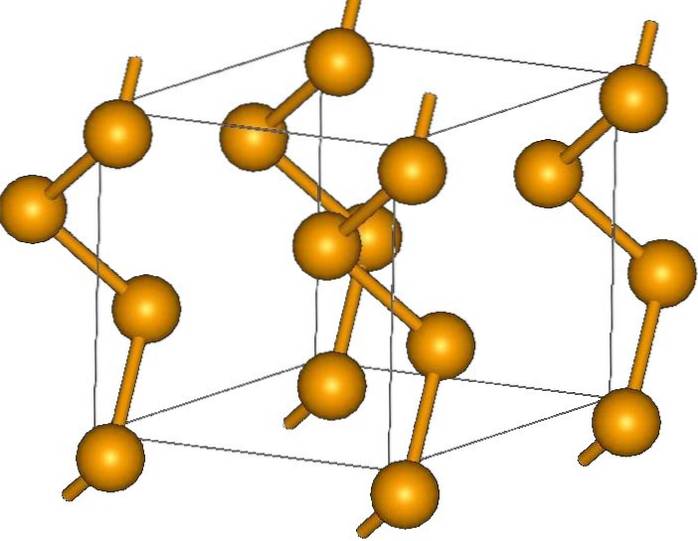
À ses extrémités, il peut y avoir des doubles liaisons terminales (-Se = Se), ou des anneaux Se8.
- Allotropes
Compte tenu du fait qu'il peut y avoir des anneaux ou des chaînes hélicoïdales de sélénium, et que leurs dimensions peuvent également varier en fonction du nombre d'atomes qu'ils contiennent, il est alors évident qu'il y a plus d'un allotrope pour cet élément; c'est-à-dire des solides de sélénium purs mais avec des structures moléculaires différentes.
Sélénium rouge
Parmi les allotropes les plus importants de sélénium, nous avons le rouge, qui peut apparaître comme une poudre amorphe, ou comme des cristaux monocliniques et polymorphes (voir l'image de Se8).
Dans le sélénium rouge amorphe, les structures sont désordonnées, sans motifs apparents; alors que dans la lentille, les anneaux établissent une structure monoclinique. Le sélénium cristallin rouge est polymorphe, ayant trois phases: α, β et γ, qui diffèrent par leurs densités..
Sélénium noir
La structure du sélénium noir se compose également d'anneaux; mais pas de huit membres, mais de beaucoup plus, atteignant des anneaux de mille atomes (Se1000). On dit alors que sa structure est complexe et constituée d'anneaux polymériques; certains plus gros ou plus petits que d'autres.
Puisqu'il existe des anneaux polymères de différentes tailles, il est difficile de s'attendre à ce qu'ils établissent un ordre structurel; donc le sélénium noir est également amorphe, mais contrairement à la poudre rougeâtre mentionnée ci-dessus, il a des textures vitreuses, bien qu'il soit cassant.
Sélénium gris
Et enfin, parmi les allotropes les plus simples du sélénium est le gris, qui se démarque des autres car il est le plus stable dans des conditions normales, et a également un aspect métallique..
Ses cristaux peuvent être hexagonaux ou trigonaux, établis par les forces de dispersion de Londres entre ses chaînes hélicoïdales polymères (image du haut). L'angle de leurs liaisons est de 130,1 °, ce qui indique un écart positif par rapport à l'environnement tétraédrique (avec des angles de 109,5 °)..
C'est pourquoi les chaînes hélicoïdales de sélénium donnent l'impression d'être «ouvertes». À titre d'élucubration, dans cette structure les atomes se font face, donc en théorie il doit y avoir un plus grand chevauchement de leurs orbitales pour créer des bandes de conduction.
La chaleur avec l'augmentation des vibrations moléculaires endommage ces bandes lorsque les chaînes deviennent désordonnées; tandis que l'énergie d'un photon affecte directement les électrons, les excitant et favorisant leurs transactions. De ce point de vue, il est «facile» d'imaginer la photoconductivité du sélénium gris..
Où il se trouve et production
Bien que largement distribué, le sélénium est un élément rare. On le trouve dans son état natif associé au soufre et aux minéraux tels que l'eucairite (CuAgSe), la claustalite (PbSe), la naumanite (AgdeuxSe) et crookesite [(CuTiAg)deuxJe connais].
Le sélénium se trouve sous forme d'impureté qui remplace le soufre dans une petite partie des minéraux sulfureux des métaux; comme le cuivre, le plomb, l'argent, etc..
Il existe des sols dans lesquels le sélénium existe sous forme soluble de sélénates. Ceux-ci sont transportés par l'eau de pluie vers les rivières et de là, vers l'océan.
Certaines plantes sont capables d'absorber et de concentrer le sélénium. Par exemple, une tasse de noix du Brésil contient 544 µg de sélénium, une quantité qui équivaut à 777% de la quantité quotidienne recommandée de sélénium..
Chez les êtres vivants, le sélénium se trouve dans certains acides aminés, tels que: la sélénométhionine, la sélénocystéine et la méthylsélénocystéine. La sélénocystéine et le sélénite sont réduits en séléniure d'hydrogène.
Electrolyse du cuivre
Il n'y a pas d'extraction de sélénium. La majeure partie est obtenue comme sous-produit du processus de raffinage par électrolyse du cuivre, se trouvant dans le limon qui s'accumule à l'anode..
La première étape est la production de dioxyde de sélénium. Pour cela, le limon anodique est traité avec du carbonate de sodium pour produire son oxydation. Ensuite, de l'eau est ajoutée à l'oxyde de sélénium et elle est acidifiée pour former de l'acide de sélénium..
Enfin, l'acide sélénieux est traité avec du dioxyde de soufre pour le réduire et obtenir du sélénium élémentaire..
Dans un autre procédé dans le mélange de limon et de boue formé dans la production d'acide sulfurique, on obtient un sélénium rouge impur qui se dissout dans l'acide sulfurique..
De l'acide sélénieux et de l'acide sélénique se forment alors. Cet acide sélénium reçoit le même traitement que la méthode précédente.
Le chlore, qui agit sur les séléniures métalliques, peut également être utilisé pour produire des composés de sélénium chlorés volatils; tels que: SedeuxCldeux, SeCl4, SeCldeux et SeOCldeux.
Ces composés, dans un procédé réalisé dans l'eau, sont convertis en acide sélénieux, qui est traité avec du dioxyde de soufre pour libérer le sélénium..
Rôle biologique
Carence
Le sélénium est un oligo-élément essentiel pour les plantes et les animaux, dont la carence chez l'homme a provoqué des troubles graves tels que la maladie de Keshan; une maladie caractérisée par des lésions du myocarde.
De plus, une carence en sélénium est associée à l'infertilité masculine et peut jouer un rôle dans la maladie de Kashin-Beck, un type d'arthrose. En outre, une carence en sélénium a été observée dans la polyarthrite rhumatoïde.
Cofacteur enzymatique
Le sélénium est un composant d'enzymes à action antioxydante, comme la glutathion peroxydase et la thiorédoxine réductase, qui agissent pour éliminer les substances avec de l'oxygène réactif..
De plus, le sélénium est un cofacteur des hormones déiodinases thyroïdiennes. Ces enzymes sont importantes pour réguler le fonctionnement des hormones thyroïdiennes..
L'utilisation de sélénium a été rapportée dans le traitement de la maladie de Hasimoto, une maladie auto-immune avec formation d'anticorps contre les cellules thyroïdiennes.
Le sélénium a également été utilisé pour réduire les effets toxiques du mercure, car certaines de ses actions sont exercées sur les enzymes antioxydantes dépendant du sélénium..
Protéines et acides aminés
L'homme possède environ 25 sélénoprotéines qui exercent une action antioxydante de protection contre le stress oxydatif, initiée par un excès d'espèces réactives de l'oxygène (ROS) et des espèces réactives de l'azote (NOS)..
La présence des acides aminés sélénométhiocine et sélénocystéine a été détectée chez l'homme. La sélénométhionine est utilisée comme complément alimentaire dans le traitement des états de carence en sélénium.
Des risques
Une concentration corporelle élevée de sélénium peut avoir de nombreux effets néfastes sur la santé, à commencer par les cheveux cassants et les ongles cassants, jusqu'aux éruptions cutanées, à la chaleur, à l'œdème de la peau et à une douleur intense.
Lors du traitement du sélénium en contact avec les yeux, les personnes peuvent ressentir des brûlures, des irritations et des larmoiements. Pendant ce temps, une exposition prolongée à de la fumée riche en sélénium peut provoquer un œdème pulmonaire, une haleine à l'ail et une bronchite..
De plus, la personne peut présenter une pneumonie, des nausées, des frissons, de la fièvre, des maux de gorge, de la diarrhée et une hépatomégalie..
Le sélénium peut interagir avec d'autres médicaments et compléments alimentaires, tels que les antiacides, les médicaments antinéoplasiques, les corticostéroïdes, la niacine et les pilules contraceptives..
Le sélénium a été associé à un risque accru de cancer de la peau. Une étude du National Cancer Institute a révélé que les hommes ayant un taux corporel élevé de sélénium étaient deux fois plus susceptibles de souffrir d'un cancer agressif de la prostate..
Une étude indique que l'apport quotidien de 200 µg de sélénium augmente de 50% la possibilité de développer un diabète de type II.
Applications
Produits de beauté
Le sulfure de sélénium est utilisé dans le traitement de la séborrhée, ainsi que des cheveux gras ou pelliculaires.
Médecins
Il est utilisé comme médecine alternative dans le traitement de la maladie de Hasimoto, une maladie auto-immune de la thyroïde.
Le sélénium réduit la toxicité du mercure, l'une de ses activités toxiques s'exerce sur les enzymes désoxydantes, qui utilisent le sélénium comme cofacteur.
Électrolyse du manganèse
L'utilisation d'oxyde de sélénium dans l'électrolyse du manganèse réduit considérablement les coûts de la technique, car elle réduit la consommation d'électricité.
Pigment
Le sélénium est utilisé comme pigment dans les peintures, les plastiques, les céramiques et le verre. Selon le sélénium utilisé, la couleur du verre varie du rouge profond à l'orange clair..
Photoconducteur
En raison de la propriété du sélénium gris de modifier sa conductivité électrique en fonction de l'intensité de la lumière qui le rayonne, le sélénium a été utilisé dans les photocopieurs, les photocellules, les photomètres et les cellules solaires..
L'utilisation du sélénium dans les photocopieurs était l'une des principales applications du sélénium; mais l'apparition de photoconducteurs organiques a réduit leur utilisation.
Cristaux
Le sélénium est utilisé pour la décoloration des verres, en raison de la présence de fer qui produit une coloration verte ou jaune. De plus, il permet une coloration rouge du verre, en fonction de l'usage que vous souhaitez lui donner..
Vulcanisation
Le diéthyldithiocarbonate de sélénium est utilisé comme agent de vulcanisation dans les produits en caoutchouc.
Alliages
Le sélénium est utilisé en combinaison avec le bismuth dans le laiton pour remplacer le plomb; Élément très toxique dont l'utilisation diminue en raison des recommandations des organisations de santé.
Le sélénium est ajouté en faibles concentrations à l'acier et aux alliages de cuivre pour améliorer la facilité d'utilisation de ces métaux..
Redresseurs
Les redresseurs au sélénium ont commencé à être utilisés en 1933 jusqu'aux années 1970, lorsqu'ils ont été remplacés par du silicium en raison de son faible coût et de sa qualité supérieure..
Les références
- Institut royal australien de chimie. (2011). Sélénium. [PDF]. Récupéré de: raci.org.au
- Wikipédia. (2019). Sélénium. Récupéré de: en.wikipedia.org
- Sato Kentaro. (s.f.). Nouveaux allotropes des principaux éléments du groupe. [PDF]. Récupéré de: tcichemicals.com
- Dr Dough Stewart. (2019). Faits sur les éléments de sélénium. Chemicool. Récupéré de: chemicool.com
- Robert C. Brasted. (28 août 2019). Sélénium. Encyclopædia Britannica. Récupéré de: britannica.com
- Marques Miguel. (s.f.). Sélénium. Récupéré de: nautilus.fis.uc.pt
- Helmenstine, Anne Marie, Ph.D. (03 juillet 2019). Faits sur le sélénium. Récupéré de: thinkco.com
- Lenntech B. V. (2019). Tableau périodique: sélénium. Récupéré de: lenntech.com
- Tinggi U. (2008). Sélénium: son rôle d'antioxydant dans la santé humaine. Santé environnementale et médecine préventive, 13(2), 102-108. doi: 10.1007 / s12199-007-0019-4
- Bureau des compléments alimentaires. (9 juillet 2019). Sélénium: fiche d'information pour les professionnels de la santé. Institut national de la santé. Récupéré de: ods.od.nih.gov



Personne n'a encore commenté ce post.