
Caractéristiques du syncytiotrophoblaste, fonction, apoptose placentaire
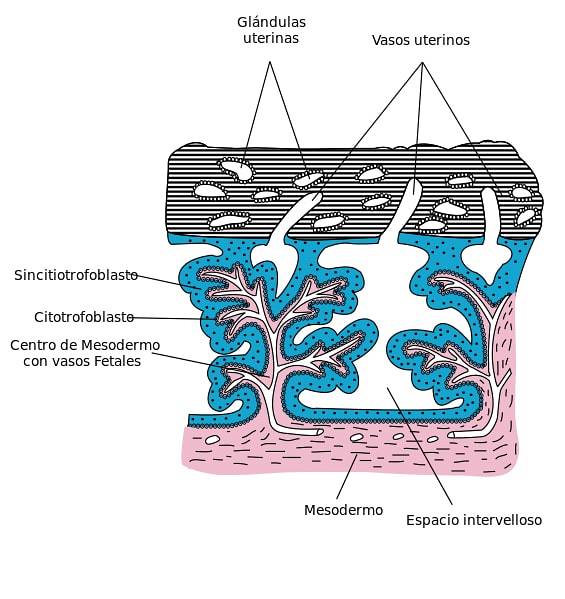
le syncytiotrophoblaste C'est une masse cytoplasmique multinucléée qui forme la couche externe du trophoblaste et entre en contact avec le tissu maternel. Cette couche cellulaire envahit l'épithélium et le stroma de l'endomètre au cours du développement embryonnaire des mammifères. Les cellules qui composent le syncytiotrophoblaste fusionnent les unes avec les autres, perdant leurs membranes cellulaires.
Cette couche de cellules provient de la différenciation cellulaire du cytotrophoblaste et est responsable de l'échange de gaz et de nutriments entre la mère et le fœtus. De plus, il est capable de produire des hormones et des peptides dans la phase d'implantation du blastocyste vers l'endomètre et la formation du placenta..
Index des articles
- 1 Fonctionnalités
- 2 Rôle dans le développement embryonnaire
- 2.1 Nidation ou implantation
- 2.2 Circulation utéro-placentaire
- 3 Apoptose placentaire
- 3.1 Apoptose et prééclampsie
- 3.2 Preuve de la relation entre l'apoptose et la prééclampsie
- 4 Références
Caractéristiques
Comme son nom l'indique, les cellules syncytiotrophoblastes ont perdu leurs membranes et ont fusionné, donnant à cette couche cellulaire un aspect syncytial multinucléé..
Ces cellules recouvrent en permanence la surface des villosités choriales, la caduque basale et la plaque chorionique et font partie de la barrière placentaire qui est responsable de la séparation du sang maternel et fœtal..
Le syncytiotrophoblaste provient de la prolifération et de la fusion de cellules cytotrophoblastes. Les cellules de cette couche n'ont pas de capacité proliférative, c'est-à-dire qu'elles ne subissent pas de mitose, de sorte que l'expansion et le maintien de cette couche cellulaire ne dépendent que de l'incorporation continue de cellules du cytotrophoblaste, garantissant sa fonctionnalité..
Ces cellules ont des complexes de Golgi et un réticulum endoplasmique lisse et rugueux abondant, ainsi qu'un grand nombre de mitochondries et d'inclusions lipidiques..
Cette couche de cellules a également une fonction de sécrétion, libérant de la progestérone, des œstrogènes, de la gonadotrophine chorionique humaine (hCG) et des lactogènes. Au fur et à mesure que le matériau cellulaire vieillit, il est enveloppé dans une membrane protectrice et éliminé par la circulation maternelle..
Rôle dans le développement embryonnaire
Nidation ou implantation
Le blastocyste rejoint l'endomètre en initiant une étape de prolifération cellulaire rapide, avec la différenciation du trophoblaste en cytotrophoblaste et syncytiotrophoblaste. Ce dernier s'étend à travers l'épithélium de l'endomètre jusqu'à ce qu'il atteigne son stroma, où les cellules se remplissent de lipides et de glycogène, devenant des cellules déciduales..
Ces cellules déciduales subissent des processus dégénératifs qui leur permettent de fournir des nutriments à l'embryon en développement..
Une fois le blastocyste implanté dans l'endomètre par le processus d'implantation ou de nidification, la fusion des cellules les plus externes du trophoblaste donne naissance au syncytiotrophoblaste primitif.
Plus tard, des lagunes se forment, occupées par des sécrétions glandulaires de l'endomètre, qui seront plus tard remplacées par du sang maternel, en affaiblissant les vaisseaux capillaires et les veinules de l'endomètre..
Ces espaces intracellulaires remplis de sang maternel définissent la phase lacunaire ou trabéculaire et s'étendent jusqu'à atteindre le côté opposé du point d'implantation..
Les lacunes du syncytiotrophoblaste sont appelées trabécules. L'embryogenèse, qui consiste en des modifications de l'embryoblaste à l'intérieur du blastocyste, se produit également à ce stade..
Circulation utéro-placentaire
L'une des fonctions fondamentales du syncytiotrophoblaste est l'échange métabolique entre la mère et le fœtus, démontrant une activité endocrinienne élevée et participant à l'homéostasie du développement embryonnaire..
L'apparition de lacunes intracellulaires ou trophoblastiques dans le syncytiotrophoblaste initie le développement de la circulation utéro-placentaire. Les sinusoïdes dérivés des capillaires de la partie maternelle du placenta s'écoulent dans ces lagunes..
Un écoulement directionnel est formé par la pression différentielle entre les vaisseaux circulatoires et les lagunes trophoblastiques. Ce flux va des artères aux veines, formant la circulation utéro-placentaire primitive..
Il y a un transfert de nutriments des vaisseaux maternels vers l'embryon, ce qui est évident en observant les vésicules pinocytaires abondantes du syncytiotrophoblaste..
La couche de cellules syncytiales tapisse les villosités flottantes du placenta. Ces villosités entrent en contact avec le sang maternel lors de l'établissement de la circulation utéro-placentaire, régulant ainsi le transport de l'oxygène et des nutriments..
Apoptose placentaire
L'apoptose ou la mort cellulaire programmée s'avère être un élément important du développement embryonnaire, ainsi l'élimination des cellules sélectionnées se produit, pour éviter la perte aveugle de cellules. La fusion syncytiale des cellules cytotrophoblastes est la phase initiale de la cascade apoptotique.
Au stade initial de l'apoptose, les cellules cytotrophoblastes prolifèrent et fusionnent pour former la couche syncytiale ou syncytiotrophoblaste..
Dans la phase d'exécution de l'apoptose, le matériel cytoplasmique et nucléique du cytotrophoblaste est passé dans la couche syncytiale, les cellules de cette dernière couche sont donc équipées du matériel nécessaire au démarrage de la cascade apoptotique..
Le processus apoptotique présente une pause temporaire en raison de l'action des enzymes anti-apoptotiques, cependant, l'enzyme caspase 3 réactive ce processus, car elle active à son tour les composants qui dégradent les protéines et les acides nucléiques dans les cellules. D'autres enzymes responsables de la dégradation des microfilaments cellulaires sont activées.
Après la dégradation des composants cellulaires, les déchets sont conditionnés dans les membranes apicales du syncytiotrophoblaste, à l'origine des ganglions syncytiaux ou apoptotiques, qui seront finalement libérés dans la circulation sanguine de la mère..
Apoptose et prééclampsie
La prééclampsie est une pathologie présentée pendant la grossesse. Certaines recherches ont montré que cette pathologie est causée par une altération de la différenciation du trophoblaste due à un excès de processus apoptotiques à ce niveau.
La libération de déchets apoptotiques dans la circulation sanguine maternelle ne provoque pas de réponses inflammatoires chez la mère car ces déchets sont protégés par une membrane qui les empêche d'entrer en contact avec les structures maternelles. Le processus de revêtement des débris prend quelques semaines.
Dans la prééclampsie, il y a un excès de prolifération et de fusion des cellules cytotrophoblastes, ce qui provoque une augmentation de la dégradation cellulaire dans le syncytiotrophoblaste. Cette augmentation provoque une accumulation de débris cellulaires, et un retard dans la formation de leur membrane protectrice..
Cela provoque l'entrée de débris et de microfragments partiellement dégradés, y compris les enzymes syncytiotrophoblastes dans la circulation sanguine de la mère, causant des lésions tissulaires. En plus de la prééclampsie, les états hypoxiques du placenta ont été associés à une augmentation de l'apoptose cellulaire.
Preuve de la relation entre l'apoptose et la prééclampsie
Des concentrations cytoplasmiques significatives de microfragments du syncytiotrophoblaste ont été observées chez des patients atteints de prééclampsie. Ces microfragments peuvent modifier le comportement des macrophages, provoquant à la fois une activation accrue des neutrophiles et une diminution de la relaxation endothéliale..
Ces altérations des cellules sanguines maternelles expliquent les dommages systémiques et la manifestation de la prééclampsie, qui provoque des lésions épithéliales et une réponse inflammatoire. En plus de causer des dommages au placenta en raison d'une augmentation des dépôts de fibrinoïdes sur les villosités.
Les références
- Flores, A. M., Montoya, J. B., Aguilar, A. O., et Ortega, F. V. (2006). Développement et validation d'un modèle de culture in vitro pour l'étude de la différenciation du trophoblaste humain. Gynécologie et obstétrique du Mexique, 74 (12), 657-665.
- Hernández-Valencial, M., Valencia-Ortega, J., Ríos-Castillo, B., Cruz-Cruz, P. D. R., et Vélez-Sánchez, D. (2014). Éléments d'implantation et de placentation: aspects cliniques et méléculaires. Journal mexicain de médecine de la reproduction, 6 (2), 102-116.
- Reece, E. A. et Hobbins, J. C. (2010). Obstétrique clinique / obstétrique clinique. Panamerican Medical Ed..
- Rodríguez, M., Couve, C., Egaña, G., et Chamy, V. (2011). Apoptose placentaire: mécanismes moléculaires dans la genèse de la prééclampsie. Journal chilien d'obstétrique et de gynécologie, 76 (6), 431-438.
- Ross, M. H. et Pawlina, W. (2007). Histologie. Panamerican Medical Ed..
- Roura, L. C. (2007). Obstétrique et médecine maternelle et fœtale. Panamerican Medical Ed..


Personne n'a encore commenté ce post.