
Structure solide amorphe, propriétés, exemples
Les solides amorphes Ce sont ceux qui n'ont pas de structure ordonnée à long terme. Ils sont à l'opposé de ce que l'on appelle un solide cristallin. Ses particules sont associées de manière désordonnée, semblable à celle des liquides, mais avec suffisamment de force pour se fondre en une structure solide..
Ce caractère amorphe est plus courant que vous ne le pensez; c'est en fait un des états possibles que peut adopter la matière condensée. On comprend ainsi que tout composé capable de se solidifier et donc de cristalliser peut également s'agglomérer de manière désordonnée si les conditions expérimentales le permettent..

Ce qui précède s'applique généralement aux substances pures, qu'il s'agisse d'éléments ou de composés. Mais c'est également valable dans le cas des mélanges. De nombreux mélanges solides sont amorphes, comme la barbe à papa, le chocolat, la mayonnaise ou la purée de pommes de terre..
Le fait qu'un solide soit amorphe ne le rend pas moins précieux qu'un cristallin. Le désordre structurel lui confère parfois des propriétés uniques qu'il ne présenterait pas à l'état cristallin. Par exemple, dans l'industrie photovoltaïque, le silicium amorphe est préféré au cristallin pour certaines applications à petite échelle..
Index des articles
- 1 Structure des solides amorphes
- 2 propriétés
- 3 Préparation
- 4 Exemples de solides amorphes
- 4.1 Minéraux et plastiques
- 4.2 Tissu biologique
- 4.3 Lunettes
- 4.4 Carbone et métaux
- 5 Références
Structure des solides amorphes
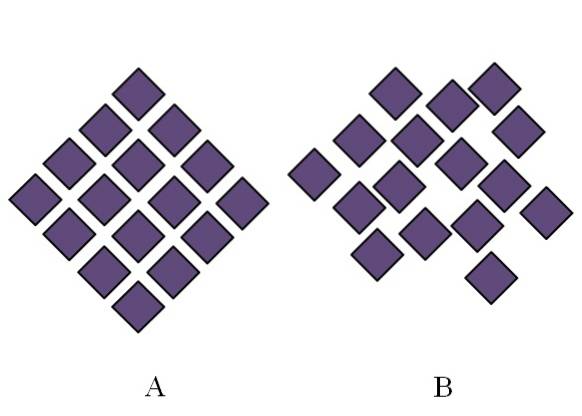
La structure d'un solide amorphe est désordonnée; il manque de périodicité ou de modèle structurel. L'image ci-dessus illustre ce point. A correspond à un solide cristallin, tandis que B représente un solide amorphe. Notez que dans B les losanges violets sont disposés arbitrairement, même si dans A et B il y a le même type d'interactions.
Si B est également observé, on verra qu'il y a des espaces qui semblent vides; c'est-à-dire que la structure présente des défauts ou des irrégularités. Par conséquent, une partie du désordre microscopique ou interne d'un solide amorphe est due au fait que ses particules sont "disposées" de telle manière que la structure résultante présente de nombreuses imperfections..
Dans un premier temps, il a été fait mention de la portée du degré de classement des solides amorphes. En B, il n'y a que quelques losanges qui semblent parfaitement alignés. Il peut y avoir des régions ordonnées; mais seulement à courte portée.
On dit alors qu'un solide amorphe est composé de minuscules cristaux incommensurables de différentes structures. La somme de toutes ces structures finit par devenir labyrinthique et dénuée de sens: la structure globale devient amorphe, constituée de blocs cristallins sans fin éparpillés partout..
Propriétés
Les propriétés d'un solide amorphe varient en fonction de la nature de ses particules constitutives. Cependant, certaines caractéristiques générales peuvent être mentionnées. Les solides amorphes peuvent être vitreux, lorsqu'ils présentent des aspects similaires aux cristaux; ou gélatineux, résineux ou poussiéreux.
Comme leurs structures sont désordonnées, ils ne génèrent pas de spectres de diffraction des rayons X fiables. De même, leurs points de fusion ne sont pas précis, mais couvrent plutôt une plage de valeurs..
Par exemple, le point de fusion d'un solide amorphe peut aller de 20 à 60 ° C. Pendant ce temps, les solides cristallins fondent à une température spécifique, ou dans une plage étroite s'ils contiennent de nombreuses impuretés..
Une autre caractéristique des solides amorphes est que lorsqu'ils se cassent ou se fracturent, ils ne produisent pas de fragments géométriques à faces planes, mais des fragments irréguliers à faces courbes. Lorsqu'elles ne sont pas vitreuses, elles apparaissent comme des corps poussiéreux et opaques.
préparation
Plutôt qu'un solide amorphe, ce concept devrait être traité comme un «état amorphe». Tous les composés (ioniques, moléculaires, polymériques, métalliques, etc.) sont capables, dans une certaine mesure, et si les conditions expérimentales le permettent, de former des solides amorphes et non cristallins..
Par exemple, dans les synthèses organiques, les composés solides sont initialement obtenus sous forme de masses pulvérulentes. Sa teneur en impuretés est si élevée qu'elles affectent son ordre moléculaire de manière importante. C'est pourquoi lorsque le produit recristallise encore et encore, le solide devient de plus en plus cristallin; il perd son caractère amorphe.
Cela ne veut pas dire, cependant, que les solides amorphes sont nécessairement des matériaux impurs; plusieurs d'entre eux sont amorphes par leur propre nature chimique.
Une substance pure peut se solidifier de manière amorphe si son liquide est soudainement refroidi, de telle sorte que ses particules ne cristallisent pas, mais adoptent une configuration vitreuse. Le refroidissement est si rapide que les particules n'ont pas assez de temps pour accueillir les blocs cristallins qui parviennent à peine à "naître".
L'eau, par exemple, est capable d'exister à l'état vitreux et amorphe, et pas seulement sous forme de glace.
Exemples de solides amorphes
Minéraux et plastiques

Pratiquement n'importe quel matériau cristallin peut se conformer à une forme amorphe (et vice versa). Cela se produit avec certains minéraux qui, pour des raisons géochimiques, n'ont pas pu établir formellement leurs cristaux conventionnels. D'autres, par contre, ne forment pas des cristaux mais du verre; tel est le cas de l'obsidienne.
D'autre part, les polymères ont tendance à se solidifier de manière amorphe, car leurs molécules sont trop grandes pour définir une structure ordonnée. C'est là qu'interviennent les résines, les caoutchoucs, la mousse de polystyrène (anime), les plastiques, le téflon, la bakélite, entre autres..
Tissu biologique
Les solides biologiques sont pour la plupart amorphes, tels que: les tissus organiques, la peau, les cheveux, la cornée, etc. De même, la graisse et les protéines forment des masses amorphes; qui cependant, avec une préparation appropriée, peuvent cristalliser (cristaux d'ADN, protéines, graisses).
Lunettes

Bien qu'il soit resté presque le dernier, le solide amorphe le plus représentatif est de loin le verre lui-même. Sa composition est essentiellement la même que celle du quartz: SiOdeux. Le cristal de quartz et le verre sont des réseaux covalents tridimensionnels; seulement que le réseau de verre est désordonné, avec des liaisons Si-O de différentes longueurs.

Le verre est le solide amorphe par excellence, et on dit que les matériaux qui prennent une apparence similaire ont un état vitreux..
Carbone et métaux
Nous avons du charbon amorphe, le charbon actif étant l'un des plus importants en raison de ses capacités d'absorption. De même, il existe du silicium amorphe et du germanium, avec des applications électroniques où ils agissent comme des semi-conducteurs..
Et enfin, il existe des alliages amorphes qui n'établissent pas de structure cristalline en raison de la disparité de leurs atomes métalliques..
Les références
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Rachel Bernstein et Anthony Carpi. (2020). Propriétés des solides. Récupéré de: visionlearning.com
- Wikipédia. (2020). Solide amorphe. Récupéré de: en.wikipedia.org
- Richard Zallen, Ronald Walter Douglas et autres. (31 juillet 2019). Solide amorphe. Encyclopædia Britannica. Récupéré de: britannica.com
- Elsevier B.V. (2020). Solide amorphe. ScienceDirect. Récupéré de: sciencedirect.com
- Danielle Reid. (2020). Solide amorphe: définition et exemples. Étude. Récupéré de: study.com
- Oeuvre de cube de Rubik. (2008). Qu'est-ce qu'un matériau amorphe? Récupéré de: web.physics.ucsb.edu



Personne n'a encore commenté ce post.