
Processus de résolution, différences avec l'hydratation et exemples

La solvatation est la liaison physique et chimique entre les particules de soluté et de solvant dans une solution. Il diffère du concept de solubilité par le fait qu'il n'y a pas d'équilibre thermodynamique entre un solide et ses particules dissoutes..
Cette union est responsable de la «disparition» des solides dissous au regard des spectateurs; alors qu'en réalité, les particules deviennent très petites et se retrouvent «couvertes» par des nappes de molécules de solvant, ce qui les rend impossibles à observer.
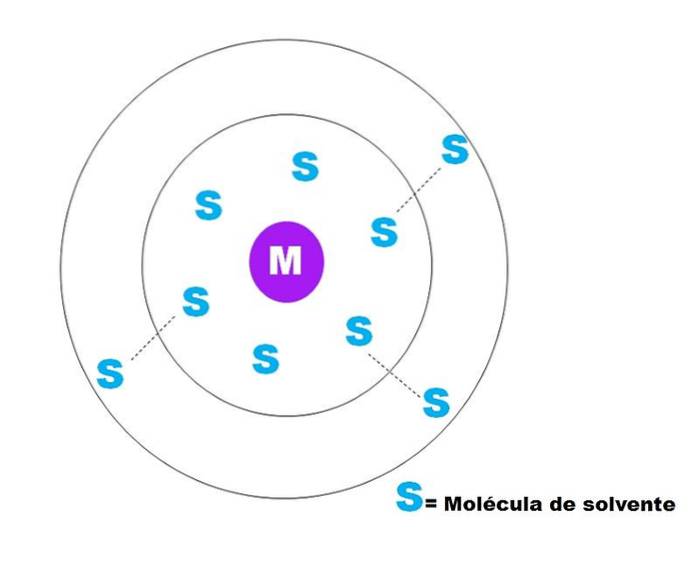
Une esquisse très générale de la solvatation d'une particule M est représentée dans l'image ci-dessus.M peut bien être un ion (M+) ou une molécule; et S est la molécule de solvant, qui peut être n'importe quel composé à l'état liquide (bien qu'il puisse également être gazeux).
Notez que M est entouré de six molécules de S, qui composent ce que l'on appelle sphère de solvatation primaire. D'autres molécules S à une plus grande distance interagissent par les forces de Van der Waals avec les premières, formant une sphère de solvatation secondaire, et ainsi de suite jusqu'à ce qu'un certain tri ne soit pas évident..
Index des articles
- 1 Processus de résolution
- 2 Aspects énergétiques
- 3 Interactions intermoléculaires
- 4 différences avec l'hydratation
- 5 exemples
- 5.1 Chlorure de calcium
- 5.2 Urée
- 5.3 Nitrate d'ammonium
- 6 Références
Processus de résolution
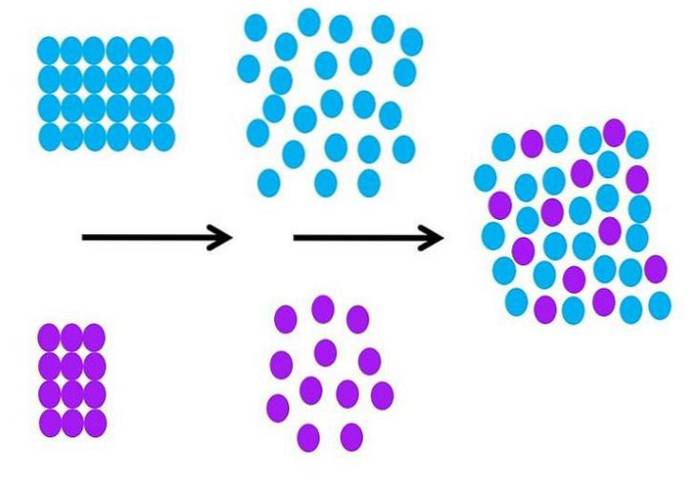
Moléculairement, comment se déroule le processus de solvatation? L'image ci-dessus résume les étapes nécessaires.
Les molécules de solvant, de couleur bleue, sont initialement ordonnées, toutes interagissant les unes avec les autres (S-S); et les particules de soluté violet (ions ou molécules) font de même avec des interactions M-M fortes ou faibles.
Pour que la solvatation se produise, le solvant et le soluté doivent se dilater (deuxième flèche noire) pour permettre les interactions soluté-solvant (M-S)..
Cela implique nécessairement une diminution des interactions soluté-soluté et solvant-solvant; diminution qui nécessite de l'énergie, et donc cette première étape est endothermique.
Une fois que le soluté et le solvant se sont dilatés moléculairement, les deux se mélangent et s'échangent de place dans l'espace. Chaque cercle violet de la deuxième image peut être comparé à celui de la première image.
Un changement dans le degré de classement des particules peut être détaillé dans l'image; ordonné au début et désordonné à la fin. En conséquence, la dernière étape est exothermique, puisque la formation des nouvelles interactions M-S stabilise toutes les particules de la solution..
Aspects énergétiques
Derrière le processus de solvatation, de nombreux aspects énergétiques doivent être pris en compte. Premièrement: interactions S-S, M-M et M-S.
Lorsque les interactions M-S, c'est-à-dire entre le soluté et le solvant, sont beaucoup plus élevées (fortes et stables) par rapport à celles des composants individuels, on parle d'un processus de solvatation exothermique; et par conséquent, de l'énergie est libérée dans le milieu, ce qui peut être vérifié en mesurant l'augmentation de température avec un thermomètre.
Si, au contraire, les interactions M-M et S-S sont plus fortes que les interactions M-S, alors pour «se développer», elles auront besoin de plus d'énergie qu'elles n'en gagnent une fois la solvatation terminée..
On parle alors d'un procédé de solvatation endothermique. Cela étant le cas, une baisse de température est enregistrée, ou ce qui est pareil, les environs sont refroidis.
Deux facteurs fondamentaux déterminent si un soluté se dissout ou non dans un solvant. Le premier est le changement d'enthalpie de la solution (ΔHdis), comme il vient d'être expliqué, et le second est le changement d'entropie (ΔS) entre le soluté et le soluté dissous. Généralement, ΔS est associé à l'augmentation du désordre également mentionnée ci-dessus.
Interactions intermoléculaires
Il a été mentionné que la solvatation est le résultat de la liaison physique et chimique entre le soluté et le solvant; Cependant, comment exactement ces interactions ou unions?
Si le soluté est un ion, M+, les interactions dites ion-dipôle se produisent (M+-S); et s'il s'agit d'une molécule, il y aura des interactions dipôle-dipôle ou des forces de diffusion de Londres.
Lorsqu'on parle d'interactions dipôle-dipôle, on dit qu'il y a un moment dipolaire permanent dans M et S. Ainsi, la région δ- riche en électrons de M interagit avec la région pauvre en électrons δ + de S. Le résultat de toutes ces interactions est la formation de plusieurs sphères de solvatation autour de M.
De plus, il existe un autre type d'interaction: la coordination. Ici, les molécules S forment des liaisons de coordination (ou datif) avec M, formant diverses géométries.
Une règle fondamentale pour mémoriser et prédire l'affinité entre le soluté et le solvant est: égal dissout égal. Par conséquent, les substances polaires se dissolvent très facilement dans des solvants également polaires; et les substances non polaires, se dissolvent dans des solvants non polaires.
Différences avec l'hydratation
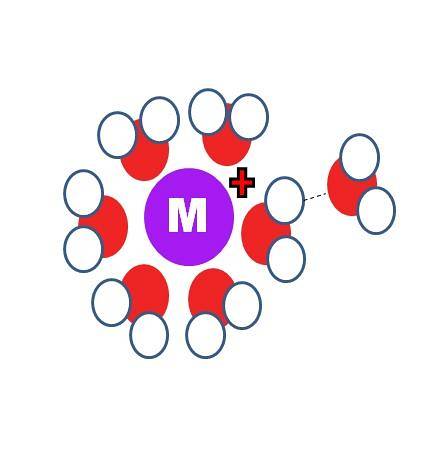
En quoi la solvatation est-elle différente de l'hydratation? Les deux processus identiques, sauf que les molécules S, dans la première image, sont remplacées par celles de l'eau, H-O-H.
Dans l'image du haut, vous pouvez voir un cation M+ entouré de six molécules HdeuxO. Notez que les atomes d'oxygène (de couleur rouge) sont dirigés vers la charge positive, car elle est la plus électronégative et a donc la densité négative la plus élevée δ-.
Derrière la première sphère d'hydratation, d'autres molécules d'eau sont regroupées par des liaisons hydrogène (OHdeux-Ohdeux). Ce sont des interactions ion-dipôle. Cependant, les molécules d'eau peuvent également former des liaisons de coordination avec le centre positif, surtout s'il est métallique..
Ainsi, les fameux aquacomplexes, M (OHdeux)n. Puisque n = 6 dans l'image, les six molécules sont orientées autour de M dans un octaèdre de coordination (la sphère interne d'hydratation). En fonction de la taille de M+, l'ampleur de sa charge et sa disponibilité électronique, cette sphère peut être plus petite ou plus grande.
L'eau est peut-être le solvant le plus surprenant de tous: elle dissout une quantité incommensurable de solutés, est un solvant trop polaire et a une constante diélectrique anormalement élevée (78,5 K).
Exemples
Trois exemples de solvatation dans l'eau sont mentionnés ci-dessous.
Chlorure de calcium
La dissolution du chlorure de calcium dans l'eau libère de la chaleur sous forme de solvate de cations Ca.deux+ et anions Cl-. La CAdeux+ s'entoure d'un nombre de molécules d'eau égal ou supérieur à six (Cadeux+-Ohdeux).
De même, le Cl- est entouré d'atomes d'hydrogène, la région δ + de l'eau (Cl--HdeuxOU ALORS). La chaleur dégagée peut être utilisée pour faire fondre des masses de glace.
Urée
Dans le cas de l'urée, c'est une molécule organique de structure HdeuxN-CO-NHdeux. Lorsqu'elles sont solvatées, les molécules HdeuxOu il forme des liaisons hydrogène avec les deux groupes amino (-NHdeux-Ohdeux) et avec le groupe carbonyle (C = O-HdeuxOU ALORS). Ces interactions sont responsables de sa grande solubilité dans l'eau..
De même, sa dissolution est endothermique, c'est-à-dire qu'elle refroidit le réservoir d'eau où elle est ajoutée.
Nitrate d'ammonium
Le nitrate d'ammonium, comme l'urée, est un soluté qui refroidit la solution après la solvatation de ses ions. NH4+ est solvaté d'une manière similaire à Cadeux+, bien que probablement parce qu'il est de géométrie tétraédrique, il a moins de molécules HdeuxOu autour de vous; et le NON3- est solvaté de la même manière que les anions Cl- (OHdeux-OU ALORSdeuxNON-HdeuxOU ALORS).
Les références
- Glasstone S. (1970). Traité de chimie et de physique. Aguilar, S.A., Madrid, Espagne.
- Whitten, Davis, Peck et Stanley. Chimie. (8e éd.). Apprentissage CENGAGE.
- Ira N. Levine. (2014). Principes de physicochimie. Sixième édition. Mc Graw Hill.
- Dictionnaire Chemicool. (2017). Définition de la résolution. Récupéré de: chemicool.com
- Belford R. (s.f.). Processus de résolution. Chimie LibreTexts. Récupéré de: chem.libretexts.org
- Wikipédia. (2018). Solvation. Récupéré de: en.wikipedia.org
- Hardinger A. Steven. (2017). Glossaire illustré de chimie organique: Solvation. Récupéré de: chem.ucla.edu
- Surfez sur Guppy. (s.f.). Le processus de résolution. Récupéré de: surfguppy.com



Personne n'a encore commenté ce post.