
Structure du sulfure de cuivre, propriétés, utilisations

le sulfure de cuivre est une famille de composés inorganiques dont la formule chimique générale est CuXSOui. Oui X C'est plus grand que Oui cela signifie que ledit sulfure est plus riche en cuivre qu'en soufre; et si au contraire, X Il est plus petit que Oui, alors le soufre est plus riche en soufre que le cuivre.
De nombreux minéraux prédominent dans la nature, représentant des sources naturelles de ce composé. Presque tous sont plus riches en cuivre qu'en soufre, et leur composition est exprimée et simplifiée par la formule CuXS; ici X peut même prendre des valeurs fractionnaires, indicatives d'un solide non stoechiométrique (Cu1,75S, par exemple).

Bien que le soufre soit jaune dans son état élémentaire, ses composés dérivés apparaissent de couleur foncée; c'est également le cas du sulfure de cuivre. Cependant, la covelite minérale (image du haut), qui est principalement composée de CuS, présente un éclat métallique et une irisation bleutée..
Ils peuvent être préparés à partir de différentes sources de cuivre et de soufre, en utilisant différentes techniques et en faisant varier les paramètres de synthèse. Ainsi, vous pouvez obtenir des nanoparticules de CuS avec des morphologies intéressantes.
Index des articles
- 1 Structure du sulfure de cuivre
- 1.1 Liens
- 1.2 Coordonnées dans la covelita
- 1.3 Autres cristaux
- 2 propriétés
- 2.1 Général
- 2.2 Covelite
- 3 utilisations
- 3.1 Nanoparticules en médecine
- 3.2 Nanosciences
- 4 Références
Structure du sulfure de cuivre
Liens
Ce composé a l'apparence d'être cristallin, on peut donc immédiatement penser qu'il est composé d'ions Cu+ (cuivre monovalent), Cudeux+ (cuivre divalent), Sdeux- et, inclusivement, Sdeux- et Sdeuxdeux- (anions disulfure), qui interagissent par des forces électrostatiques ou des liaisons ioniques.
Cependant, il existe un léger caractère covalent entre Cu et S, et par conséquent la liaison Cu-S ne peut être exclue. A partir de ce raisonnement, la structure cristalline du CuS (et celle de tous ses solides dérivés) commence à différer de celles trouvées ou caractérisées pour d'autres composés ioniques ou covalents..
En d'autres termes, on ne peut pas parler d'ions purs, mais au milieu de leurs attractions (cation-anion) il y a un léger chevauchement de leurs orbitales externes (partage d'électrons).
Coordonnées à la covelita
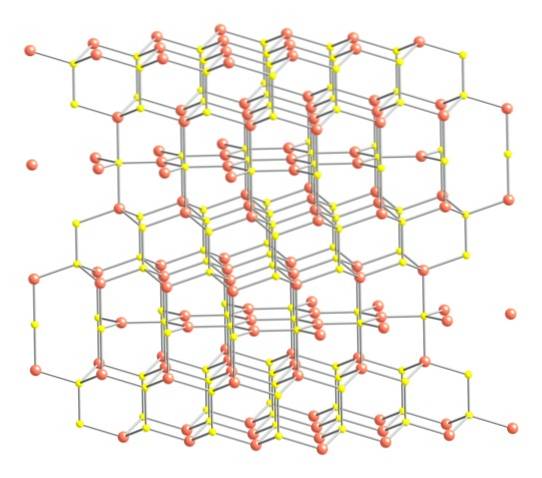
Cela dit, la structure cristalline de la covelite est montrée dans l'image supérieure. Il se compose de cristaux hexagonaux (définis par les paramètres de leurs cellules unitaires), où les ions s'unissent et s'orientent dans des coordinations différentes; ce sont, avec un nombre varié de voisins proches.
Dans l'image, les ions cuivre sont représentés par des sphères roses, tandis que les ions soufre sont représentés par des sphères jaunes..
En focalisant d'abord l'attention sur les sphères roses, on notera que certaines sont entourées de trois sphères jaunes (coordination du plan trigonal), et d'autres de quatre (coordination tétraédrique)..
Le premier type de cuivre, trigonal, peut être identifié dans les plans perpendiculaires aux faces hexagonales en regard du lecteur, dans lesquels se trouvent quant à eux le deuxième type de carbone, tétraédrique.
En ce qui concerne maintenant les sphères jaunes, certaines ont cinq sphères roses comme voisines (coordination bipyramide trigonale), et d'autres trois et une sphère jaune (encore une fois, coordination tétraédrique); Dans ce dernier, l'anion disulfure est vu, ce qui peut être vu ci-dessous et dans la même structure de la covelite:
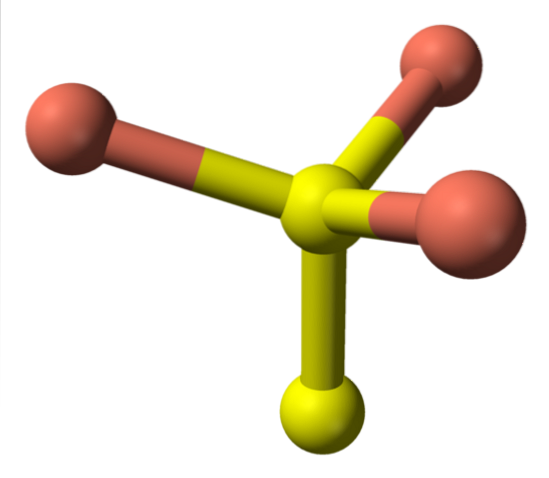
Formule alternative
Il y a alors des ions Cudeux+, Cu+, Sdeux- et Sdeuxdeux-. Cependant, des études réalisées avec la spectroscopie photoélectronique aux rayons X (XPS), indiquent que tout le cuivre est sous forme de cations Cu+; et par conséquent, la formule initiale CuS, est exprimée «mieux» comme (Cu+)3(S2−) (Sdeux)-.
Notez que le rapport Cu: S pour la formule ci-dessus continue d'être 1, et en outre les charges s'annulent.
Autres cristaux
Un sulfure de cuivre peut adopter des cristaux orthorhombiques, comme dans le polymorphe, γ-CudeuxS, de chalcocite; cubique, comme dans un autre polymorphe de chalcocite, α-CudeuxS; tétragonale, dans l'anilite minérale, Cu1,75S; monocliniques, dans la djurleita, Cu1,96Oui, entre autres.
Pour chaque cristal défini, il y a un minéral, et à son tour, chaque minéral a ses propres caractéristiques et propriétés.
Propriétés
Général
Les propriétés du sulfure de cuivre sont soumises au rapport Cu: S de ses solides. Par exemple, ceux avec des anions Sdeuxdeux- ont des structures hexagonales et peuvent être des semi-conducteurs ou des conducteurs métalliques.
Si, au contraire, la teneur en soufre consiste simplement en anions Sdeux-, les sulfures se comportent comme des semi-conducteurs et présentent également des conductivités ioniques à des températures élevées. En effet, ses ions commencent à vibrer et à se déplacer dans les cristaux, transportant ainsi des charges électriques..
Optiquement, bien que cela dépende également de leur composition en cuivre et en soufre, les sulfures peuvent ou non absorber un rayonnement dans la région infrarouge du spectre électromagnétique. Ces propriétés optiques et électriques en font des matériaux potentiels à mettre en œuvre dans différentes gammes d'appareils..
Une autre variable à considérer, en plus du rapport Cu: S, est la taille des cristaux. Ce n'est pas seulement qu'il y a plus de sulfures de cuivre «soufre» ou «cuivré», mais les dimensions de leurs cristaux confèrent un effet imprécis sur leurs propriétés; Ainsi, les scientifiques sont impatients d'étudier et de rechercher des applications pour les nanoparticules de Cu.XSOui.
Covelite
Chaque sulfure de minerai ou de cuivre a des propriétés uniques. Cependant, de tous, la covelite est la plus intéressante d'un point de vue structurel et esthétique (en raison de son irisation et de ses tons bleus). Par conséquent, certaines de ses propriétés sont mentionnées ci-dessous.
Masse molaire
95,611 g / mol.
Densité
4,76 g / mL.
Point de fusion
500 ° C; mais ça tombe en panne.
Solubilité dans l'eau
3,3 10-5 g / 100 mL à 18 ° C.
Applications
Nanoparticules en médecine
Non seulement la taille des particules varie jusqu'à ce qu'elles atteignent des dimensions nanométriques, mais leurs morphologies peuvent également varier considérablement. Ainsi, le sulfure de cuivre peut former des nanosphères, des tiges, des plaques, des films minces, des cages, des câbles ou des tubes..
Ces particules et leurs morphologies attractives acquièrent des applications individuelles dans différents domaines de la médecine..
Par exemple, des nanocages ou des sphères vides peuvent servir de vecteurs de médicaments dans le corps. Des nanosphères ont été utilisées, soutenues par des électrodes en verre de carbone et des nanotubes de carbone, pour fonctionner comme des détecteurs de glucose; ainsi que ses agrégats sont sensibles à la détection de biomolécules comme l'ADN.
Les nanotubes CuS surpassent les nanosphères dans la détection du glucose. En plus de ces biomolécules, des immunocapteurs ont été conçus à partir de couches minces de CuS et de certains supports pour la détection d'agents pathogènes..
Les nanocristaux et les agrégats amorphes de CuS peuvent même provoquer l'apoptose des cellules cancéreuses, sans endommager les cellules saines.
Nanoscience
Dans la sous-section précédente, il était dit que ses nanoparticules faisaient partie de biocapteurs et d'électrodes. En plus de ces utilisations, scientifiques et techniciens ont également profité de ses propriétés pour concevoir des cellules solaires, des condensateurs, des batteries au lithium et des catalyseurs pour des réactions organiques très spécifiques; Éléments indispensables en nanoscience.
Il convient également de mentionner que lorsqu'il est supporté sur du charbon actif, l'ensemble NpCuS-CA (CA: Activated Carbon et Np: Nanoparticles) s'est avéré servir d'élimination des colorants nocifs pour l'homme et, par conséquent, fonctionne comme un purificateur de sources de les molécules indésirables absorbant l'eau.
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Sulfure de cuivre. Récupéré de: en.wikipedia.org
- Ivan Grozdanov et Metodija Najdoski. (Année mille neuf cents quatre-vingts-quinze). Propriétés optiques et électriques des films de sulfure de cuivre de composition variable. Journal of Solid State Chemistry Volume 114, numéro 2, 1er février 1995, pages 469-475. doi.org/10.1006/jssc.1995.1070
- Centre national d'information sur la biotechnologie. (2019). Sulfure de cuivre (CuS). Base de données PubChem. CID = 14831. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Peter A. Ajibade et Nandipha L. Botha. (2017). Synthèse, propriétés optiques et structurelles
- de nanocristaux de sulfure de cuivre provenant de précurseurs de molécule unique. Department of Chemistry, University of Fort Hare, Private Bag X1314, Alice 5700, Afrique du Sud. Nanomatériaux, 7, 32.
- Collaboration: Auteurs et éditeurs des volumes III / 17E-17F-41C (s.f.). Structure cristalline des sulfures de cuivre (Cu2S, Cu (2-x) S), paramètres du réseau. Dans: Madelung O., Rössler U., Schulz M. (eds) Non-Tetrahedrally Bonded Elements and Binary Compounds I. Landolt-Börnstein- Group III Condensed Matter (Numerical Data and Functional Relationships in Science and Technology), vol 41C. Springer, Berlin, Heidelberg.
- Momtazan, F., Vafaei, A., Ghaedi, M. et al. Korean J. Chem. Eng. (2018). Application de nanoparticules de sulfure de cuivre chargées de charbon actif pour l'adsorption simultanée de colorants ternaires: méthodologie de surface de réponse. 35: 1108. doi.org/10.1007/s11814-018-0012-1
- Goel, S., Chen, F., et Cai, W. (2014). Synthèse et applications biomédicales des nanoparticules de sulfure de cuivre: des capteurs aux théranostiques. Small (Weinheim an der Bergstrasse, Allemagne), 10 (4), 631-645. doi: 10.1002 / smll.201301174



Personne n'a encore commenté ce post.