
Justification, techniques et utilisations de la coloration des spores

La coloration des spores C'est la méthodologie utilisée pour colorer les structures de résistance qui forment certains genres bactériens lorsqu'ils sont dans des conditions défavorables; ces structures correspondent à une forme de survie.
Il existe de nombreux genres qui forment des spores; cependant, les principaux sont Bacillus et Clostridium. Ces genres sont considérés comme plus pertinents car ils contiennent des espèces pathogènes pour l'homme..
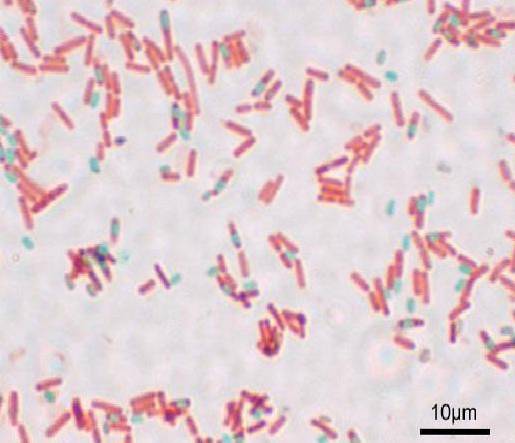
Chaque bacille peut donner naissance à une spore. Au moment de la coloration de la préparation, la spore peut être trouvée dans le bacille (endospore) ou à l'extérieur (exospore). Avec les techniques de coloration conventionnelles pour les bactéries - telles que la coloration de Gram - les spores restent incolores.
Actuellement, il existe plusieurs méthodologies de coloration capables de pénétrer la structure épaisse de la spore pour la teindre. Ces méthodologies sont très variées; Il s'agit notamment de la technique Dorner, de la coloration Möeller et de la méthodologie Shaeffer-Fulton, également connue sous le nom de Wirtz-Conklin..
De toutes les techniques mentionnées, la méthodologie Shaeffer-Fulton est la plus utilisée dans les laboratoires de routine. Il porte le nom de deux microbiologistes qui ont créé la coloration en 1930: Alicia Shaeffer et MacDonald Fulton. Cependant, la technique est parfois appelée Wirtz-Conklin en l'honneur de deux bactériologistes des années 1900..
Index des articles
- 1 Justification
- 2 techniques de coloration des spores
- 2.1 Technique de Dorner
- 2.2 Technique de Dorner modifiée
- 2.3 Technique de Shaeffer-Fulton ou Wirtz-Conklin
- 2.4 Technique de Möeller
- 2.5 Technique Möeller modifiée sans chaleur
- 3 utilisations
- 3.1 Exemples
- 4 Références
Base
Les spores ne se tachent pas avec les colorants conventionnels car elles ont une paroi très épaisse. La composition complexe des spores empêche l'entrée de la plupart des colorants.
Si la spore est étudiée de l'extérieur vers l'intérieur, les couches suivantes sont observées: la première est l'exosporium, qui est la couche la plus mince et la plus externe formée par les glycoprotéines.
Vient ensuite la cuticule, qui offre une résistance aux températures élevées, suivie du cortex composé de peptidoglycane. Plus tard se trouve le mur de la base qui protège le protoplaste.
La spore est une structure déshydratée qui contient 15% de calcium et d'acide dipicolinique. Pour cette raison, la plupart des techniques de coloration des spores reposent sur l'application de chaleur afin que le colorant puisse pénétrer dans la structure épaisse..
Une fois que la spore est tachée, elle ne peut pas éliminer le colorant. Dans la technique Shaeffer-Fulton, le vert malachite pénètre dans les cellules végétatives et, lorsque la chaleur est appliquée, pénètre également dans l'endospore et les exospores..
En lavant à l'eau, le colorant est éliminé de la cellule végétative. Cela se produit parce que le colorant vert malachite est légèrement basique, il se lie donc faiblement à la cellule végétative..
Au lieu de cela, il ne peut pas sortir de la spore et le bacille est finalement contre-coloré avec de la safranine. Cette base est valable pour le reste des techniques, dans lesquelles quelque chose de similaire se produit.
Techniques de coloration des spores
Pour effectuer la coloration des spores, vous devez avoir une culture pure de la souche suspecte que vous souhaitez étudier..
La culture est soumise à des températures extrêmes pendant 24 heures pour stimuler la sporulation du micro-organisme. Pour cela, la culture peut être placée dans une étuve à 44 ° C ou au réfrigérateur (8 ° C) pendant 24 ou 48 heures..
Si laissé trop longtemps aux températures mentionnées, seules les exospores seront observées, puisque toutes les endospores auront déjà quitté le bacille.
À la fin du temps, quelques gouttes de solution physiologique stérile doivent être déposées sur une lame propre. Ensuite, une petite partie de la culture est prélevée et une fine tartinade est faite.
Il est ensuite laissé sécher, mis au chaud et teint avec l'une des techniques expliquées ci-dessous:
Technique Dorner
1- Préparer une suspension concentrée du microorganisme sporulé dans de l'eau distillée dans un tube à essai et ajouter un volume égal de fuchsine Kinyoun carbol filtrée.
2- Placer le tube dans un bain d'eau bouillante pendant 5 à 10 minutes.
3- Sur une lame propre, mélanger une goutte de la suspension précédente avec une goutte d'une solution aqueuse à 10% de nigrosine, bouillie et filtrée..
4- Étalez et séchez rapidement à feu doux.
5- Examiner avec un objectif 100X (immersion).
Les spores tachent de rouge et les cellules bactériennes apparaissent presque incolores sur un fond gris foncé.
Technique Dorner modifiée
1- Une suspension du microorganisme sporulé est étalée sur une lame et fixée à la chaleur.
2- L'échantillon est recouvert d'une bande de papier filtre à laquelle est ajoutée de la fuchsine carbolique. Le colorant est chauffé pendant 5 à 7 minutes à la flamme du bec Bunsen jusqu'à générer un dégagement de vapeurs. Ensuite, le papier est retiré.
3- La préparation est lavée à l'eau puis séchée avec du papier absorbant.
4- Couvrir le frottis avec une fine pellicule de 10% de nigrosine, en utilisant une deuxième lame pour étaler la nigrosine ou une aiguille.
La coloration que prennent les spores et les bactéries est la même que celle décrite dans l'art antérieur.
Technique de Shaeffer-Fulton ou Wirtz-Conklin
1- Faire un frottis fin avec une suspension du microorganisme sporulé sur une lame et fixer à chauffer.
2- Couvrir la lame avec une solution aqueuse de vert malachite à 5% (un papier filtre peut être placé sur la lame).
3- Chauffer sur la flamme du bec Bunsen pour provoquer le dégagement de vapeurs et éliminer la flamme. Répétez l'opération pendant 6 à 10 minutes. Si la solution de vert malachite s'évapore trop pendant la procédure, plus.
4- Retirer le papier filtre (si installé) et laver à l'eau.
5- Couvrir la lame avec de la safranine aqueuse à 0,5% pendant 30 secondes (certaines variantes de la technique utilisent de la safranine aqueuse à 0,1% et la laisser pendant 3 minutes).
Avec cette technique, les spores apparaissent en vert et les bacilles en rouge..
Il présente l'inconvénient que les endospores des jeunes cultures ne se colorent pas bien, car elles semblent extrêmement claires ou incolores. Pour éviter cela, il est recommandé d'utiliser des cultures de 48 heures d'incubation..
Technique Möeller
1- Couvrir le frottis de chloroforme pendant 2 minutes.
2- Jeter le chloroforme.
3- Couvrir d'acide chromique à 5% pendant 5 minutes.
4- Laver à l'eau distillée
5- La feuille est recouverte de carbol fuchsin-fenicada et exposée à la flamme du bec Bunsen jusqu'à l'émission de vapeurs; puis il est retiré de la flamme pendant quelques instants. L'opération est répétée jusqu'à ce que 10 minutes soient terminées.
6- Laver à l'eau.
7- Utilisez de l'éthanol acidifié (alcool chlorhydrique) pour décolorer. Laisser agir 20 ou 30 secondes.
8- Laver à l'eau distillée.
9- Contrastiner en recouvrant la feuille de bleu de méthylène pendant 5 minutes.
10- Laver à l'eau distillée.
11- Laisser sécher et porter l'échantillon au microscope.
Les spores apparaissent en rouge et les bacilles en bleu. Il est important de ne pas respirer les vapeurs, car elles sont toxiques et à long terme peuvent être cancérigènes..
Technique Möeller modifiée sans chaleur
En 2007, Hayama et ses collaborateurs ont créé une modification de la technique Möeller. Ils ont éliminé l'étape de chauffage du colorant et l'ont remplacé en ajoutant 2 gouttes de tensioactif Tergitol 7 pour 10 ml de solution de carbol fuchsine-carbol. Les mêmes résultats ont été obtenus.
Applications
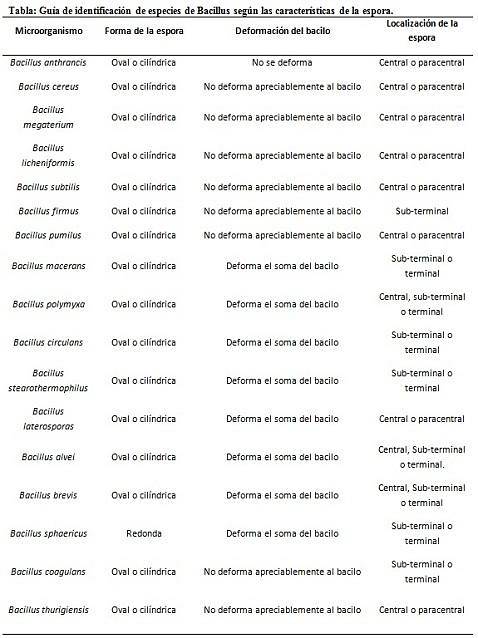
La coloration des spores fournit des informations très précieuses et utiles pour l'identification de l'agent pathogène, car sa présence, sa forme, sa localisation dans le bacille et sa capacité à déformer la cellule végétative ou non, sont des données qui peuvent guider l'espèce. certain genre.
Dans ce contexte, il vaut la peine de dire que les spores peuvent être rondes ou ovales, elles peuvent être situées au centre ou également en position paracentrale, subminale ou terminale..
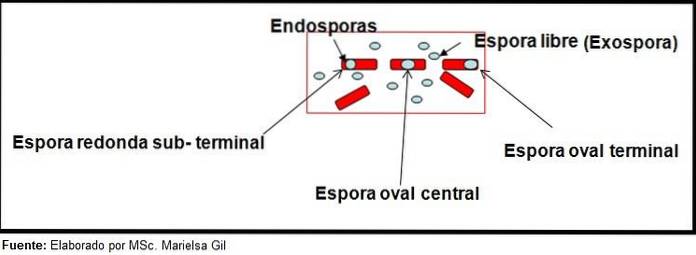
Exemples
- Clostridium difficile forme une spore ovale en position terminale qui déforme le bacille.
- La spore de Clostridium tertium il est ovale, ne déforme pas le bacille et se situe au niveau terminal.
- L'endospore de Clostridium tétani est terminal et déforme le bacille, donnant l'apparence d'un pilon.
- Spores de Clostridium botulinum, C. histolyticum, C. novy Oui C. septicum ils sont subterminaux ronds ou ovales et déforment le bacille.
- L'endospore de Clostridium sordelli est situé en position centrale, avec une légère déformation.
Les références
- Hayama M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, Kawakami Y. Proposition d'une technique simplifiée pour colorer les spores bactériennes sans appliquer la modification thermiquement réussie de la méthode de Moeller. Eur J Med Res.2007; 16 12 (8): 356-9.
- Contributeurs Wikipedia. Tache de Moeller. Wikipedia, l'encyclopédie libre. 3 novembre 2018, 03:28 UTC. Disponible sur: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). Manuel de laboratoire des techniques microbiologiques. Département des sciences fondamentales de l'Académie de microbiologie. Institut polytechnique national.
- "Endospore." Wikipedia, l'encyclopédie libre. 25 févr.2018, 10:20 UTC. 10 janv.2019, 02:42: en.wikipedia.org
- Silva L, Silva C, Fernández N, Bueno C, Torres J, Rico M, Macías J et collaborateurs. (2006). Personnel du travail de la communauté autonome d'Estrémadure. Ordre du jour spécifique Volume IV. Éditorial MAD. Séville-Espagne, pp 211-212.
- Silva M, García M, Corrales J, Ponce E. (2006). Technicien spécialiste de laboratoire, Service de santé de Galice (SERGAS). Thème spécifique de l'ordre du jour volume 2. Éditorial MAD. Séville-Espagne, pp 79-80.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnostic microbiologique. (5e éd.). Argentine, Éditorial Panamericana S.A.
- Forbes B, Sahm D, Weissfeld A. 2009. Bailey & Scott Microbiological Diagnosis. 12 éd. Argentine. Éditorial Panamericana S.A

Personne n'a encore commenté ce post.