
Caractéristiques, morphologie et cycle de vie de Trypanosoma brucei
Trypanosoma brucei c'est un protozoaire parasite extracellulaire. Il appartient à la classe des Kinetoplastidae, famille du genre Trypanosomatidae Trypanosome. Il existe deux sous-espèces qui causent deux variantes différentes de la trypanosomose humaine africaine ou également appelée «maladie du sommeil».
Trypanosoma brucei subsp. Gambiense, provoque la forme chronique et 98% des cas, localisés en Afrique subsaharienne occidentale et centrale. Trypanosoma brucei subsp. Rhodesian est la cause de la forme aiguë, présente en Afrique subsaharienne centrale et orientale.
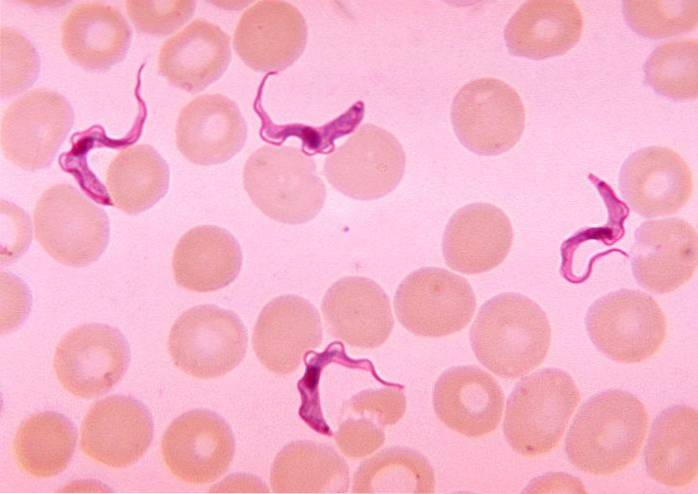
Les deux variantes de cette maladie ont été signalées dans les pays d'Afrique subsaharienne où se trouve la mouche tsé-tsé., Glossina spp, le vecteur ou l'agent de transmission de T. brucei.
Une troisième sous-espèce, Trypanosoma brucei subsp. Brucei, provoque une maladie similaire chez les animaux domestiques et sauvages, appelée nagana.
La «maladie du sommeil» menace plus de 60 millions de personnes dans 36 pays d'Afrique subsaharienne. Il y a environ 300 000 à 500 000 cas par an, dont environ 70 000 à 100 000 meurent. L'infestation par la mouche tsé-tsé couvre une superficie de 10 millions de kilomètres carrés, soit un tiers de la masse terrestre de l'Afrique.
L'Organisation mondiale de la santé reconnaît une diminution significative du nombre de nouveaux cas de trypanosomiase humaine africaine ces dernières années. Cela est dû à la persistance des initiatives nationales et internationales de lutte contre cette maladie..
Index des articles
- 1 Caractéristiques générales
- 1.1 La découverte
- 1.2 Génétique
- 1.3 «Maladie du sommeil» et réchauffement climatique
- 2 Phylogénie et taxonomie
- 3 Morphologie
- 3.1 Forme trypomastigote
- 3.2 Forme Epimastigote
- 3.3 Le kinétosome
- 4 Cycle de vie
- 4.1 Chez l'hôte (humain ou autre mammifère)
- 4.2 Chez la mouche tsé-tsé (le vecteur)
- 5 Symptômes de contagion
- 5.1 Première phase
- 5.2 Deuxième phase
- 5.3 Diagnostic
- 6 Traitement
- 7 Références
Caractéristiques générales
Elle est appelée «maladie du sommeil» car elle provoque une inversion du cycle naturel du sommeil chez le patient. La personne dort pendant la journée et reste éveillée la nuit. C'est le produit de la série de troubles psychiques et neurologiques que la maladie provoque dans sa phase avancée..
La découverte
La trypanosomiase animale ou nagana est une maladie majeure du bétail en Afrique. A été identifié Trypanosoma brucei comme agent causal en 1899. C'était David Bruce alors qu'il enquêtait sur une importante épidémie de nagana dans le Zululand.
Par la suite, Aldo Castellani a identifié cette espèce de trypanosome dans le sang et le liquide céphalo-rachidien de patients humains atteints de «maladie du sommeil»..
Entre 1902 et 1910, les deux variantes de la maladie chez l'homme et leurs sous-espèces responsables ont été identifiées. Les animaux et les humains peuvent agir comme des réservoirs pour les parasites capables de provoquer des maladies chez les humains..
La génétique
Le génome du noyau de Trypanosoma brucei Il est composé de 11 chromosomes diploïdes et d'une centaine de microchromosomes. Au total, il a 9 068 gènes. Le génome mitochondrial (le kinétoplaste) est constitué de nombreuses copies d'ADN circulaire.
«Maladie du sommeil» et réchauffement climatique
La trypanosomiase humaine africaine est considérée comme l'une des 12 maladies infectieuses humaines pouvant être aggravées par le réchauffement climatique.
En effet, à mesure que la température ambiante augmente, la zone susceptible d'être occupée par la mouche s'étendra. Glossina sp. Au fur et à mesure que la mouche colonise de nouveaux territoires, elle emportera le parasite avec elle.
Phylogénie et taxonomie
Trypanosoma brucei pIl appartient au royaume Protista, au groupe Excavata, au phylum des Euglenozoa, à la classe des Kinetoplastidae, à l'ordre des Trypanosomatida, à la famille des Trypanosomatidae, au genre Trypanosome, sous-genre Trypanozoon.
Cette espèce a trois sous-espèces qui causent différentes variantes de la «maladie du sommeil» chez l'homme (T. b. subsp. Gambiense Oui T. b. subsp. rhodésien) et chez les animaux domestiques et sauvages (T. b. subsp. Brucei).
Morphologie
Forme trypomastigote
Trypanosoma brucei est un organisme unicellulaire allongé de 20 μm de long et de 1 à 3 μm de large, dont la forme, la structure et la composition de la membrane varient tout au long de son cycle de vie.
Il a deux formes de base. Forme trypomastigotique avec un corps basal postérieur au noyau et un long flagelle. Ce formulaire assume à son tour des sous-types au cours du cycle de vie. Parmi ceux-ci, le sous-type court ou trapu (affaissé en anglais), il est plus épais et son flagelle est court.
Forme épimastigote
La deuxième forme de base est l'épimastigote du corps basal antérieur au noyau et le flagelle un peu plus court que le précédent..
La cellule est recouverte d'une couche de glycoprotéine de surface variable. Cette couche modifie les glycoprotéines à sa surface et évite ainsi l'attaque des anticorps générés par l'hôte..
Le système immunitaire produit de nouveaux anticorps pour attaquer la nouvelle configuration du pelage et le pelage change à nouveau. C'est ce qu'on appelle la variation antigénique.
Le kinétosome
Une caractéristique importante est la présence du kinétosome. Cette structure est constituée d'ADN mitochondrial condensé situé à l'intérieur de la seule mitochondrie présente. Cette grande mitochondrie est située à la base du flagelle.
Cycle biologique
Le cycle de vie de Trypanosoma brucei alterne entre la mouche tsé-tsé en tant que vecteur et l'humain en tant qu'hôte. Afin de se développer chez des hôtes aussi différents, le protozoaire subit d'importants changements métaboliques et morphologiques de l'un à l'autre..
À la volée, le Trypanosoma brucei habite le tube digestif, tandis que chez l'homme, il se trouve dans le sang.
Chez l'hôte (humain ou autre mammifère)
Trypanosoma brucei Il se présente sous trois formes de base tout au long de votre cycle. Lorsque la mouche mord un humain ou un autre mammifère pour extraire son sang, elle injecte de ses glandes salivaires dans la circulation sanguine une forme non proliférative du protozoaire, appelée métacyclique..
Une fois dans la circulation sanguine, il se transforme en une forme proliférative, appelée sang mince (mince en anglais).
La forme sanguine élancée de Trypanosoma brucei Il tire son énergie de la glycolyse du glucose dans le sang. Ce processus métabolique a lieu dans un organite appelé glycosome. Ces trypanosomes se multiplient dans différents fluides corporels: sang, lymphe et liquide céphalo-rachidien..
À mesure que le nombre de parasites dans le sang augmente, ils commencent à revenir à une forme non proliférative. Cette fois, il s'agit d'une variante de flagelle plus épaisse et plus courte, appelée potelée sanguine (courtaud).
Les trypanosomes sanguins potelés sont adaptés aux conditions du système digestif de la mouche. Ils activent vos mitochondries et les enzymes nécessaires au cycle de l'acide citrique et à la chaîne respiratoire. La source d'énergie n'est plus le glucose mais la proline.
Chez la mouche tsé-tsé (le vecteur)
Le vecteur ou agent de transmission de Trypanosoma brucei c'est la mouche tsé-tsé, Glossina spp. Ce genre regroupe 25 à 30 espèces de mouches suceuses de sang. Ils sont faciles à différencier de la mouche domestique par leur trompe particulièrement longue et leurs ailes entièrement repliées au repos..
Lorsqu'une mouche tsé-tsé mord à nouveau le mammifère hôte infecté et tire son sang, ces formes sanguines potelées pénètrent dans le vecteur.
Une fois dans le tube digestif de la mouche, les formes sanguines dodues se différencient rapidement en trypanosomes procycliques prolifératifs..
Ils se multiplient par fission binaire. Ils quittent le tube digestif de la mouche et se dirigent vers les glandes salivaires. Ils se transforment en épimastigotes ancrés aux murs par le flagelle.
Dans les glandes salivaires, ils se multiplient et se transforment en trypanosomes métacycliques, prêts à être à nouveau inoculés dans le système sanguin d'un mammifère..
Symptômes de contagion
La période d'incubation de cette maladie est de 2 à 3 jours après la piqûre de mouche. Des symptômes neurologiques peuvent apparaître après quelques mois dans le cas de T. b. subsp. Gambiense. S'il s'agit de T. b. subsp. Rhodesian, peut prendre des années à se manifester.
Première phase
La «maladie du sommeil» comporte deux étapes. Le premier est appelé stade précoce ou phase hémolymphatique, il se caractérise par la présence de Trypanosoma brucei seulement dans le sang et la lymphe.
Dans ce cas, les symptômes sont de la fièvre, des maux de tête, des douleurs musculaires, des vomissements, des ganglions lymphatiques enflés, une perte de poids, une faiblesse et une irritabilité..
Dans cette phase, la maladie peut être confondue avec le paludisme.
Deuxième étape
Le stade dit tardif ou phase neurologique (état encéphalitique), est activé avec l'arrivée du parasite dans le système nerveux central, étant détecté dans le liquide céphalo-rachidien. Ici, les symptômes sont exprimés sous forme de changements de comportement, de confusion, d'incoordination, d'altération du cycle de sommeil et enfin de coma..
Le développement de la maladie se poursuit avec un cycle allant jusqu'à trois ans dans le cas de la sous-espèce Gambiense, se terminant par la mort. Lorsque la sous-espèce est présente Rhodesian, la mort vient de semaines en mois.
Parmi les cas non soumis au traitement, 100% sont décédés. 2-8% des cas traités de manière égale meurent.
Diagnostic
Le stade du diagnostic est celui où la forme infectieuse, c'est-à-dire le trypanosome sanguin, se trouve dans le sang..
L'examen microscopique des échantillons de sang détecte la forme spécifique du parasite. En phase encéphalitique, une ponction lombaire est nécessaire pour analyser le liquide céphalo-rachidien.
Il existe différentes techniques moléculaires pour diagnostiquer la présence de Trypanosoma brucei.
Traitement
La capacité qu'il a Trypanosoma brucei faire varier constamment la configuration de sa couche externe de glycoprotéines (variation antigénique), rend très difficile le développement de vaccins contre la «maladie du sommeil».
Il n'y a pas de chimiothérapie prophylactique et peu ou pas de perspective d'un vaccin. Les quatre principaux médicaments utilisés pour la trypanosomiase humaine africaine sont toxiques.
Le mélarsoprol est le seul médicament efficace pour les deux variantes de la maladie du système nerveux central. Cependant, il est si toxique qu'il tue 5% des patients qui en reçoivent..
L'éflornithine, seule ou en association avec le nifurtimox, est de plus en plus utilisée comme première ligne de traitement pour les maladies causées par Trypanosoma brucei subsp. Gambiense.
Les références
- Fenn K et KR Matthews (2007) La biologie cellulaire de la différenciation de Trypanosoma brucei. Opinion actuelle en microbiologie. 10: 539-546.
- Fernández-Moya SM (2013) Caractérisation fonctionnelle des protéines de liaison à l'ARN RBP33 et DRBD3 en tant que régulateurs de l'expression génique de Trypanosoma brucei. THÈSE DE DOCTORAT. Institut de parasitologie et de biomédecine "López-Neyra". Éditorial Université de Grenade, Espagne. 189 p.
- García-Salcedo JA, D Pérez-Morga, P Gijón, V Dilbeck, E Pays et DP Nolan (2004) Un rôle différentiel de l'actine au cours du cycle de vie de Trypanosoma brucei. Le Journal EMBO 23: 780-789.
- Kennedy PGE (2008) Le problème persistant de la trypanosomiase humaine africaine (maladie du sommeil). Annales de neurologie, 64 (2), 116-126.
- Matthews KR (2005) La biologie cellulaire développementale de Trypanosoma brucei. J. Cell Sei. 118: 283-290.
- Welburn SC, EM Fèvre, PG Coleman, M Odiit et I Maudlin (2001) Maladie du sommeil: histoire de deux maladies. TENDANCES en parasitologie. 17 (1): 19 à 24.



Personne n'a encore commenté ce post.