
Histoire du tungstène, propriétés, structure, utilisations
le tungstène, le tungstène ou tungstène est un métal de transition lourd dont le symbole chimique est W. Il est situé dans la période 6 avec le groupe 6 du tableau périodique, et son numéro atomique est 74. Son nom a deux significations étymologiques: pierre dure et mousse de loup; de la seconde est parce que ce métal est également connu sous le nom de tungstène.
C'est un métal gris argenté et, bien qu'il soit cassant, il a une grande dureté, une grande densité et des points de fusion et d'ébullition élevés. Par conséquent, il a été utilisé dans toutes les applications qui impliquent des températures, des pressions ou des forces mécaniques élevées, telles que des forets, des projectiles ou des filaments émettant des radiations..

L'utilisation la plus connue de ce métal, au niveau culturel et populaire, est dans les filaments d'ampoules électriques. Quiconque les a manipulés réalisera à quel point ils sont fragiles; cependant, ils ne sont pas faits de tungstène pur, qui est malléable et ductile. De plus, dans les matrices métalliques telles que les alliages, il offre une excellente résistance et dureté.
Il se caractérise et se distingue par le fait qu'il est le métal ayant le point de fusion le plus élevé, et aussi en étant plus dense que le plomb lui-même, surpassé seulement par d'autres métaux tels que l'osmium et l'iridium. C'est aussi le métal le plus lourd connu pour jouer un rôle biologique dans l'organisme..
L'anion tungstate, WO4deux-, qui peut polymériser pour former des grappes en milieu acide. D'autre part, le tungstène peut former des composés intermétalliques, ou être fritté avec des métaux ou des sels inorganiques de sorte que ses solides acquièrent différentes formes ou consistances..
Il n'est pas très abondant dans la croûte terrestre, avec seulement 1,5 gramme de ce métal par tonne. De plus, comme il s'agit d'un élément lourd, son origine est intergalactique; spécifiquement des explosions de supernova, qui ont dû projeter des «jets» d'atomes de tungstène vers notre planète lors de sa formation.
Index des articles
- 1 Histoire
- 1.1 Etymologie
- 1.2 Reconnaissance et découverte
- 1.3 Aciers et ampoules
- 2 propriétés
- 2.1 Apparence physique
- 2.2 Numéro atomique
- 2.3 Masse molaire
- 2.4 Point de fusion
- 2.5 Point d'ébullition
- 2.6 Densité
- 2.7 Chaleur de fusion
- 2.8 Chaleur de vaporisation
- 2.9 Capacité thermique molaire
- 2.10 Dureté de Moh
- 2.11 Electronégativité
- 2.12 Rayon atomique
- 2.13 Résistivité électrique
- 2.14 Isotopes
- 2.15 Chimie
- 2.16 Regroupement acide
- 3 Structure et configuration électronique
- 3.1 Phases cristallines
- 3.2 Liaison métallique
- 3.3 états d'oxydation
- 4 Obtention
- 5 utilisations
- 6 Risques et précautions
- 6.1 Produits biologiques
- 6.2 Physique
- 7 Références
Histoire
Étymologie
L'histoire du tungstène ou du wolfram a deux visages comme leurs noms: l'un suisse et l'autre allemand. Dans les années 1600, dans les régions actuellement occupées par l'Allemagne et l'Autriche, les mineurs travaillaient dans les extractions de cuivre et d'étain pour produire des bronzes.
À ce moment-là, les mineurs se sont retrouvés avec une épine dans le processus: il y avait un minéral extrêmement difficile à fondre; minéral constitué de wolframite, (Fe, Mn, Mg) WO4, qui retenait ou «dévorait» l'étain comme s'il s'agissait d'un loup.
D'où l'étymologie de cet élément, «loup» pour loup en espagnol, un loup qui a mangé de l'étain; et «bélier» de mousse ou de crème, dont les cristaux ressemblaient à une longue fourrure noire. C'est ainsi que le nom de 'wolfram' ou 'wolfram' est né en l'honneur de ces premières observations.
En 1758, du côté suisse, un minéral similaire, la scheelite, CaWO4, il a été nommé `` tung sten '', ce qui signifie `` pierre dure ''.
Les deux noms, tungstène et tungstène, sont largement utilisés de manière interchangeable, en fonction uniquement de la culture. En Espagne, par exemple, et en Europe occidentale, ce métal est surtout connu sous le nom de tungstène; tandis que sur le continent américain, le nom de tungstène prédomine.
Reconnaissance et découverte
On savait alors qu'entre les XVIIe et XVIIIe siècles, il y avait deux minéraux: la wolframite et la scheelite. Mais qui a vu qu'il y avait un métal différent des autres en eux? Ils ne pouvaient être caractérisés que comme des minéraux, et c'est en 1779 que le chimiste irlandais Peter Woulfe analysa soigneusement le tungstène et en déduisit l'existence..
Du côté suisse, encore une fois, Carl Wilhelm Scheele en 1781 a pu isoler le tungstène comme WO3; et plus encore, il a obtenu de l'acide tungstique (ou tungstique), HdeuxWO4 et autres composés.
Cependant, cela ne suffisait pas pour atteindre le métal pur, car il fallait réduire cet acide; c'est-à-dire en le soumettant à un processus tel qu'il se dissocie de l'oxygène et cristallise sous forme de métal. Carl Wilhelm Scheele ne disposait pas des fours ni de la méthodologie appropriés pour cette réaction de réduction chimique.
C'est ici qu'entrèrent en action les frères espagnols d'Elhuyar, Fausto et Juan José, qui réduisirent les deux minéraux (wolframite et scheelite) avec du charbon, dans la ville de Bergara. Tous deux reçoivent le mérite et l'honneur d'être les découvreurs du wolfram métallique ou du tungstène (W).
Aciers et ampoules

Comme d'autres métaux, ses utilisations définissent son histoire. Les alliages acier-tungstène et les filaments de tungstène pour remplacer le carbone dans les ampoules électriques étaient parmi les plus importants à la fin du XIXe siècle. On peut dire que les premières ampoules, telles que nous les connaissons, ont été commercialisées en 1903-1904.
Propriétés
Apparence physique
C'est un métal gris argenté brillant. Fragile mais très dur (à ne pas confondre avec la ténacité). Si la pièce est de haute pureté, elle devient malléable et dure, autant ou plus que plusieurs aciers.
Numéro atomique
74.
Masse molaire
183,85 g / mol.
Point de fusion
3422 ° C.
Point d'ébullition
5930 ° C.
Densité
19,3 g / mL.
Température de fusion
52,31 kJ / mol.
Chaleur de vaporisation
774 kJ / mol.
Capacité thermique molaire
24,27 kJ / mol.
La dureté de Moh
7,5.
Électronégativité
2,36 sur l'échelle de Pauling.
Radio atomique
139 heures
Résistivité électrique
52,8 nΩ · m à 20 ° C.
Les isotopes
Il se produit principalement dans la nature sous forme de cinq isotopes: 182W, 183W, 184W, 186Baguette magique 180W.Selon la masse molaire de 183 g / mol, qui fait la moyenne des masses atomiques de ces isotopes (et des trente autres radio-isotopes), chaque atome de tungstène ou de tungstène contient environ cent dix neutrons (74 + 110 = 184).
Chimie
C'est un métal très résistant à la corrosion, car sa fine couche de WO3 Il le protège contre l'attaque de l'oxygène, de l'acide et des alcalis. Une fois dissous et précipités avec d'autres réactifs, on obtient ses sels, appelés tungstates ou wolframates; en eux, le tungstène a généralement un état d'oxydation de +6 (en supposant qu'il y a des cations W6+).
Regroupement acide
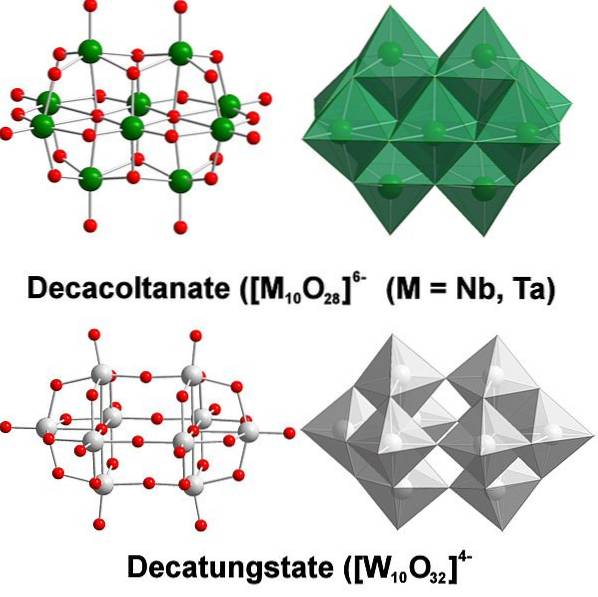
Chimiquement, le tungstène est assez particulier car ses ions ont tendance à se regrouper pour former des hétéropolyacides ou des polyoxométalates. Qui sont? Ce sont des groupes ou des amas d'atomes qui se réunissent pour définir un corps tridimensionnel; Principalement, un avec une structure sphérique en forme de cage, dans laquelle ils «enferment» un autre atome.
Tout commence par l'anion tungstate, WO4deux-, qui protonate rapidement en milieu acide (HWO4-) et se lie à un anion voisin pour former [WdeuxOU ALORS7(OH)deux]deux-; et ceci à son tour se joint à un autre [WdeuxOU ALORS7(OH)deux]deux- pour créer le [W4OU ALORS12(OH)4]4-. Ainsi de suite jusqu'à ce qu'il y ait plusieurs politungstats en solution.
Paratungstates A et B, [W7OU ALORS24]6- et HdeuxW12OU ALORS42dix-, respectivement, ils sont l'un des plus remarquables de ces polyanions.
Il peut être difficile de créer votre plan et vos structures Lewis; mais il suffit en principe de les visualiser comme des ensembles d'octaèdres WO6 (image du haut).
Notez que ces octaèdres grisâtres finissent par définir le decatungstate, un politungstat; s'il contenait un hétéroatome (par exemple, du phosphore) à l'intérieur, ce serait alors un polyoxométalate.
Structure et configuration électronique
Phases cristallines
Les atomes de tungstène définissent un cristal avec une structure cubique centrée sur le corps (cci, pour cubique centré sur le corps). Cette forme cristalline est connue sous le nom de phase α; tandis que la phase β est également cubique, mais un peu plus dense. Les deux phases ou formes cristallines, α et β, peuvent coexister en équilibre dans des conditions normales.
Les grains cristallins de la phase α sont isométriques, tandis que ceux de la phase β ressemblent à des colonnes. Indépendamment de la façon dont le cristal est, il est régi par les liaisons métalliques qui maintiennent étroitement les atomes W. Sinon, les points de fusion et d'ébullition élevés, ou la dureté et la densité élevées du tungstène, ne pourraient pas être expliqués..
Lien métallique
Les atomes de tungstène doivent être étroitement liés d'une manière ou d'une autre. Pour faire une conjecture, la configuration électronique de ce métal doit d'abord être observée:
[Xe] 4f145 j46 sdeux
Les orbitales 5d sont très grandes et floues, ce qui impliquerait qu'entre deux atomes W proches, il y a des chevauchements orbitaux effectifs. De même, les orbitales 6s contribuent aux bandes résultantes, mais dans une moindre mesure. Alors que les orbitales 4f sont "profondément en arrière-plan" et donc leur contribution à la liaison métallique est moindre.
Ceci, la taille des atomes et les grains cristallins, sont les variables qui déterminent la dureté du tungstène et sa densité..
États d'oxydation
Dans le tungstène ou le wolfram métallique, les atomes W ont un état d'oxydation nul (W0). En revenant à la configuration électronique, les orbitales 5d et 6s peuvent être "vidées" d'électrons selon que W est en compagnie d'atomes hautement électronégatifs, tels que l'oxygène ou le fluor..
Lorsque les deux électrons 6s sont perdus, le tungstène a un état d'oxydation +2 (Wdeux+), ce qui provoque la contraction de son atome.
S'il perd également tous les électrons de ses orbitales 5d, son état d'oxydation deviendra +6 (W6+); De là, il ne peut pas devenir plus positif (en théorie), car les orbitales 4f, parce qu'elles sont internes, auraient besoin de grandes énergies pour éliminer leurs électrons. Autrement dit, l'état d'oxydation le plus positif est +6, où le tungstène est encore plus petit.
Ce tungstène (VI) est très stable en conditions acides ou dans de nombreux composés oxygénés ou halogénés. Les autres états d'oxydation possibles et positifs sont: +1, +2, +3, +4, +5 et +6.
Le tungstène peut également gagner des électrons s'il se combine avec des atomes moins électronégatifs que lui. Dans ce cas, ses atomes deviennent plus gros. Il peut gagner un maximum de quatre électrons; c'est-à-dire avoir un état d'oxydation de -4 (W4-).
Obtention
Il a été mentionné précédemment que le tungstène se trouve dans les minéraux wolframite et scheelite. Selon le procédé, deux composés en sont obtenus: oxyde de tungstène, WO3, ou paratungstate d'ammonium, (NH4)dix(HdeuxW12OU ALORS42) · 4HdeuxO (ou ATP). L'un ou l'autre peut être réduit en W métallique avec du carbone au-dessus de 1050 ° C.
Il n'est pas économiquement rentable de produire des lingots de tungstène, car ils auraient besoin de beaucoup de chaleur (et d'argent) pour les faire fondre. C'est pourquoi on préfère le produire sous forme de poudre pour le traiter à la fois avec d'autres métaux pour obtenir des alliages..
Il est à noter que la Chine est le pays avec la plus grande production de tungstène au monde. Et sur le continent américain, au Canada, en Bolivie et au Brésil, ils occupent également la liste des plus grands producteurs de ce métal.
Applications

Voici quelques-unes des utilisations connues de ce métal:
-Ses sels étaient utilisés pour colorer les cotons d'anciens vêtements de théâtre.
-Combiné avec de l'acier, il le durcit encore plus, pouvant même résister aux coupures mécaniques à haute vitesse.
-Les filaments de tungstène frittés sont utilisés depuis plus de cent ans dans les ampoules électriques et les lampes halogènes. De plus, en raison de son point de fusion élevé, il a servi de matériau pour les tubes à rayons cathodiques et pour les buses des moteurs-fusées..
-Remplace le plomb dans la fabrication de projectiles et de boucliers radioactifs.
-Les nanofils de tungstène peuvent être utilisés dans les nanodispositifs sensibles au pH et aux gaz.
-Des catalyseurs au tungstène ont été utilisés pour traiter la production de soufre dans l'industrie pétrolière.
-Le carbure de tungstène est le plus largement utilisé de tous ses composés. Du renforcement des outils de coupe et de forage, ou de la fabrication de pièces d'armement militaire, à l'usinage du bois, des plastiques et de la céramique.
Risques et précautions
Biologique
Étant un métal relativement rare dans la croûte terrestre, ses effets négatifs sont rares. Dans les sols acides, les polyungstates peuvent ne pas affecter les enzymes qui utilisent des anions molybdate; mais dans les sols basiques, le WO4deux- intervient (positivement ou négativement) dans les processus métaboliques de MoO4deux- et cuivre.
Les plantes, par exemple, peuvent absorber des composés solubles de tungstène, et lorsqu'un animal les mange, puis après avoir consommé sa viande, les atomes W pénètrent dans notre corps. La plupart sont expulsés dans l'urine et les excréments, et on sait peu de choses sur ce qui arrive aux autres..
Des études chez l'animal ont montré que lorsqu'ils inhalent de fortes concentrations de tungstène en poudre, ils développent des symptômes similaires à ceux du cancer du poumon..
Par ingestion, un humain adulte aurait besoin de boire des milliers de gallons d'eau enrichie en sels de tungstène pour montrer une inhibition appréciable des enzymes cholinestérase et phosphatase..
Physique
En termes généraux, le tungstène est un élément faiblement toxique et, par conséquent, il existe peu de risques environnementaux pour la santé..
Concernant le tungstène métallique, évitez de respirer sa poussière; et si l'échantillon est solide, il convient de garder à l'esprit qu'il est très dense et qu'il peut causer des dommages physiques s'il tombe ou frappe d'autres surfaces.
Les références
- Bell Terence. (s.f.). Tungstène (Wolfram): propriétés, production, applications et alliages. L'équilibre. Récupéré de: thebalance.com
- Wikipédia. (2019). Tungstène. Récupéré de: en.wikipedia.org
- Lenntech B.V. (2019). Tungstène. Récupéré de: lenntech.com
- Jeff Desjardins. (1er mai 2017). L'histoire du tungstène, le métal naturel le plus puissant sur Terre. Récupéré de: visualcapitalist.com
- Doug Stewart. (2019). Faits sur les éléments de tungstène. Récupéré de: chemicool.com
- Art Fisher et Pam Powell. (s.f.). Tungstène. Université du Nevada. Récupéré de: unce.unr.edu
- Helmenstine, Anne Marie, Ph.D. (02 mars 2019). Faits sur le tungstène ou le Wolfram. Récupéré de: thinkco.com



Personne n'a encore commenté ce post.