
Structure, fonctions, propriétés, synthèse de l'uracile
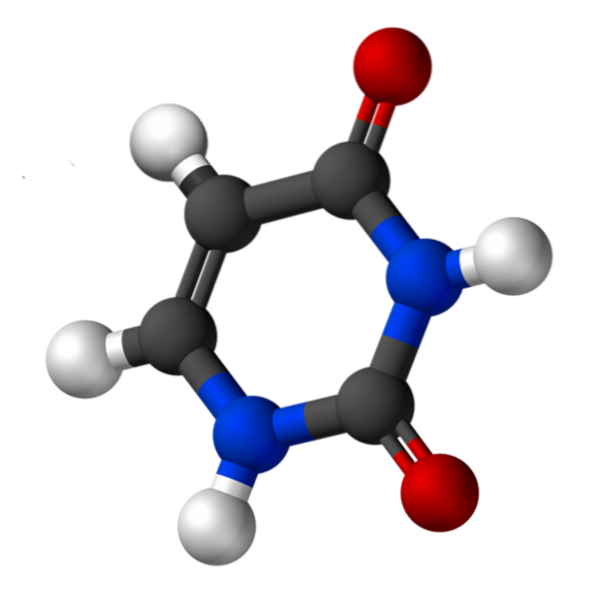
le uracile Il s'agit d'une base azotée de type pyrimidine, présente dans l'acide ribonucléique (ARN). C'est l'une des caractéristiques qui différencient l'ARN de l'acide désoxyribonucléique (ADN), puisque ce dernier contient de la thymine au lieu de l'uracile. Les deux substances, l'uracile et la thymine, ne diffèrent que par le fait que la seconde a un groupe méthyle.
D'un point de vue évolutif, il a été proposé que l'ARN ait été la première molécule à stocker des informations génétiques et à fonctionner comme un catalyseur dans les cellules, avant l'ADN et les enzymes. Pour cette raison, on pense que l'uracile a joué un rôle clé dans l'évolution de la vie.
Chez les êtres vivants, l'uracile ne se trouve pas sous forme libre, mais forme généralement des nucléotides monophosphate (UMP), diphosphate (UDP) et triphosphate (UTP). Ces nucléotides uraciles ont différentes fonctions, telles que la biosynthèse de l'ARN et du glycogène, l'interconversion isomérique des sucres et la régulation de la glutamine synthase..
Index des articles
- 1 Structure et propriétés
- 2 Biosynthèse
- 2.1 Régulation de la biosynthèse
- 3 Rôle dans la biosynthèse de l'ARN
- 4 Rôle dans la biosynthèse du sucre
- 5 Rôle dans l'interconversion isomérique des sucres
- 6 Rôle dans la biosynthèse des glycoprotéines
- 7 Rôle dans la régulation de la glutamine synthase
- 8 Rôle dans l'édition de l'ARN
- 9 Biosynthèse de l'UDP-glucose
- 10 Uracil ADN glycosylase
- 11 Références
Structure et propriétés
Uracil, appelé 2,4-dioxypyridine, a la formule empirique C4H4NdeuxOU ALORSdeux, dont le poids moléculaire est de 112,09 g / mol, et est purifié sous forme de poudre blanche.
La structure de l'uridine est un cycle hétérocyclique avec quatre atomes de carbone et deux atomes d'azote, avec des doubles liaisons alternées. Est planaire.
Il a une solubilité de 50 mg / ml, à 25 ° C, dans la soude 1M, et un pKa compris entre 7,9 et 8,2. La longueur d'onde où se produit son absorbance maximale (ʎmax) est compris entre 258 et 260 nm.
Biosynthèse
Il existe une voie commune pour la biosynthèse des nucléotides pyrimidiniques (uracile et cytokine). La première étape est la biosynthèse du phosphate de carbamoyle à partir du COdeux et NH4+, qui est catalysée par la carbamoyl phosphate synthétase.
La pyrimidine est construite à partir de phosphate de carboyle et d'aspartate. Les deux substances réagissent et forment le N-carbamoylaspartate, une réaction catalysée par l'aspartate transcabamoylase (ATCase). La fermeture du cycle pyrimidine est provoquée par la déshydratation catalysée par la dihydrootase et produit du L-dihydrorotate..
Le L-dihydrorotate est oxydé et converti en orotate; l'accepteur d'électrons est NAD+. C'est une réaction catalysée par la dihydroorotate déshydrogénase. L'étape suivante est le transfert du groupe phosphoribosyle, du phosphoribosyl pyrophosphate (PRPP), à l'orotate. Forme de l'orotidylate (OMP) et du pyrophosphate inorganique (PPi), catalysé par l'orotate phosphoribosyl transférase.
La dernière étape consiste en la décarboxylation du cycle pyrimidine de l'orotidylate (OMP). Forme de l'uridylate (uridine-5'-monophosphate, UMP), qui est catalysé par une décarboxylase.
Ensuite, grâce à la participation d'une kinase, un groupe phosphate est transféré de l'ATP à l'UMP, formant l'UDP (uridine-5'-diphosphate). Ce dernier est répété, formant UTP (uridin-5'-triphosphate).
Régulation de la biosynthèse
Chez les bactéries, la régulation de la biosynthèse de la pyrimidine se fait par rétroaction négative, au niveau de l'aspartate transcabamoylase (ATCase).
Cette enzyme est inhibée par le CTP (cytidine-5'-triphosphate), qui est le produit final de la voie de biosynthèse de la pyrimidine. ATCase a des sous-unités régulatrices qui se lient au régulateur allostérique CTP.
Chez l'animal, la régulation de la biosynthèse de la pyrimidine se fait par rétroaction négative, au niveau de deux enzymes: 1) la carbamoyl phosphate synthase II, qui est inhibée par l'UTP et activée par l'ATP et le PRPP; et 2) OMP décarboxylase, qui est inhibée par le produit de la réaction qu'elle catalyse, l'UMP. Le taux de biosynthèse de l'OMP varie en fonction de la disponibilité du PRPP.
Rôle dans la biosynthèse de l'ARN
L'uracile est présent dans tous les types d'ARN, tels que l'ARN messager (ARNm), l'ARN de transfert (ARNt) et l'ARN ribosomal (ARNr). La biosynthèse de ces molécules se produit par un processus appelé transcription..
Lors de la transcription, les informations contenues dans l'ADN sont copiées dans l'ARN par une ARN polymérase. Le processus inverse, dans lequel les informations contenues dans l'ARN sont copiées dans l'ADN, se produit dans certains virus et plantes par transcriptase inverse..
La biosynthèse de l'ARN nécessite le nucléoside triphosphate (NTP), à savoir: l'uridine triphosphate (UTP), le cytidine triphosphate (CTP), l'adénine triphosphate (ATP) et la guanine triphosphate (GTP). La réaction est:
(ARN)n résidus + NTP -> (ARN)n + 1 résidu + PPi
L'hydrolyse du pyrophosphate inorganique (PPi) fournit l'énergie pour la biosynthèse de l'ARN.
Rôle dans la biosynthèse du sucre
Les esters de sucre sont très courants dans les organismes vivants. Certains de ces esters sont des diphosphates d'ester nucléosidique, tels que les sucres UDP, qui sont très abondants dans les cellules. Les sucres UDP participent à la biosynthèse des disaccharides, oligosaccharides et polysaccharides.
Chez les plantes, la biosynthèse du saccharose se fait par deux voies: une primaire et une secondaire.
La voie principale est le transfert du D-glucose de l'UDP-D-glucose au D-fructose pour former du saccharose et de l'UDP. La voie secondaire comprend deux étapes: elle commence par l'UDP-D-glucose et le fructose-6-phosphate et se termine par la formation de saccharose et de phosphate..
Dans les glandes mammaires, la biosynthèse du lactose se produit à partir de l'UDP-D-galactose et du glucose.
Chez les plantes, la biosynthèse de la cellulose est réalisée par la condensation continue de résidus bêta-D-glucosyle, de l'UDP-glucose à l'extrémité non réductrice de la chaîne polyglucose en croissance. De même, la biosynthèse de l'amylose et de l'amylopectine nécessite l'UDP-glucose comme substrat donneur de glucose pour la chaîne en croissance..
Chez les animaux, l'UDP-glucose et l'ADP-glucose sont utilisés pour la biosynthèse du glycogène. De même, la biosynthèse du sulfate de chondroïtine nécessite l'UDP-xylose, l'UDP-galactose et l'UDP-glucuronate..
Rôle dans l'interconversion isomérique des sucres
La conversion du galactose en un intermédiaire de glycolyse se produit par la voie Leloir. L'une des étapes de cette voie est catalysée par l'enzyme UDP-galactose-4-épimérase, qui facilite l'interconversion de l'UDP-galactose en UDP-glucose..
Rôle dans la biosynthèse des glycoprotéines
Au cours de la biosynthèse des glycoprotéines, les protéines traversent les sacs cis, moyen et trans de l'appareil de Golgi.
Chacun de ces sacs possède un ensemble d'enzymes qui traitent les glycoprotéines. Des monomères de sucre, tels que le glucose et le galactose, sont ajoutés à l'oligosaccharide protéique de l'UDP-hexose et d'autres nucléotides-hexose.
Les nucléotides hexoses sont transportés vers les citernes de Golgi par antiport. L'UDP-galactose (UDP-Gal) et l'UDP-N-acétylgalactosamine (UDP-GalNAc) pénètrent dans les citernes du cytosol par échange contre UMP.
Dans la citerne de Golgi, une phosphatase hydrolyse un groupe phosphate sur UDP et forme UMP et Pi. L'UDP provient de réactions catalysées par la galactosyltransférase et la N-acétylgalactosamyltransférase. UMP formé par la phosphatase sert à l'échange nucléotide-hexose.
Rôle dans la régulation de la glutamine synthase
Un mécanisme de régulation de la glutamine synthase est la modification covalente, qui consiste en une adénylation, qui l'inactive, et une dédénylation, qui l'active. Cette modification covalente est réversible et catalysée par l'adényltransférase..
L'activité adényltransférase est modulée par la liaison de la protéine PII, qui est régulée par une modification covalente, l'uridinylation.
L'uridylation et la deuridylation sont toutes deux effectuées par l'uridylyltransférase. Dans cette enzyme, l'activité d'uridylation est due à la glutamine et au phosphate, et est activée par la liaison de l'alpha-cétoglutarate et de l'ATP au PII.
Rôle dans l'édition de l'ARN
Certains ARNm sont édités avant la traduction. Dans certains organismes eucaryotes, tels que Trypanosoma brucei, il y a une modification de l'ARN du transcrit du gène de la sous-unité II de la cytochrome oxydase. Cela se produit par l'insertion de résidus uracile, une réaction catalysée par l'uridyltransférase terminale..
Un ARN guide, complémentaire du produit édité, sert de modèle pour le processus d'édition. Les paires de bases formées entre le transcrit initial et l'ARN guide impliquent des paires de bases G = U qui ne sont pas Watson-Crick et sont communes dans l'ARN..
Biosynthèse UDP-glucose
Dans des conditions physiologiques, la biosynthèse du glycogène à partir du glucose-1-phosphate est thermodynamiquement impossible (ΔG positif). Pour cette raison, avant la biosynthèse, l'activation du glucose-1-phosphate (G1P) se produit. Cette réaction combine G1P et UTP pour former du glucose diphosphate d'uridine (UDP-glucose ou UDPG)..
La réaction est catalysée par l'UDP-glucose pyrophosphorylase et est la suivante:
G1P + UTP -> UDP-glucose + 2Pi.
La variation d'énergie libre de Gibbs dans cette étape est importante et négative (-33,5 KJ / mol). Au cours de la réaction à l'oxygène, G1P attaque l'atome alpha de phosphore de l'UTP et forme de l'UDP-glucose et du pyrophosphate inorganique (PPi). Ensuite, le PPi est hydrolysé par une pyrophosphatase inorganique, dont l'énergie d'hydrolyse est ce qui conduit la réaction générale.
L'UDP-glucose est une substance «à haute énergie». Il permet de former les liaisons glycosidiques entre le résidu glucose et la chaîne polysaccharidique en croissance. Ce même principe énergétique est applicable aux réactions auxquelles participent les sucres UDP, comme la biosynthèse des disaccharides, des oligosaccharides et des glycoprotéines..
ADN glycosylase uracile
Il existe des lésions d'ADN qui surviennent spontanément. L'une de ces lésions est la désamination spontanée de la cytokine et sa conversion consécutive en uracile. Dans ce cas, la réparation a lieu en éliminant la base d'ADN modifiée par une enzyme appelée uracile ADN glycosylase..
L'enzyme uracile ADN glycosylase élimine la cytokine endommagée (uracile), produisant un résidu de désoxyribose dépourvu de la base azotée, appelé site AP (site apurinique-apyrimidinique).
L'enzyme AP endonucléase coupe alors le squelette phosphodiester du site AP, éliminant le résidu sucre-phosphate. L'ADN polymérase I restaure le brin endommagé.
Les références
- Bohinski, R. 1991. Biochimie. Addison-Wesley Iberoamericana, Wilmington, Delaware.
- Devlin, T.M. 2000. Biochimie. Editorial Reverté, Barcelone.
- Lodish, H., Berk, A., Zipurski, S.L., Matsudaria, P., Baltimore, D., Darnell, J. 2003. Biologie cellulaire et moléculaire. Éditorial Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Mexique, Sāo Paulo.
- Nelson, D. L., Cox, M. M. 2008. Principes de Lehninger de biochimie. W.H. Freeman, État de New York.
- Voet, D. et Voet, J. 2004. Biochimie. John Wiley and Sons, États-Unis.


Personne n'a encore commenté ce post.