
Structure, propriétés, utilisations de l'oxyde de cérium (IV)

le oxyde de cérium (IV) L'oxyde cérique est un solide inorganique blanc ou jaune pâle qui est produit par l'oxydation du cérium (Ce) par l'oxygène jusqu'à sa valence 4+. La formule chimique de l'oxyde cérique est CeOdeux et est l'oxyde de cérium le plus stable.
Le cérium (Ce) est un élément de la série des lanthanides, qui sont inclus dans le groupe des terres rares. La source naturelle de cet oxyde est la bastnasite minérale. Dans le concentré commercial de ce minéral, le CeOdeux peut être trouvé dans une proportion approximative allant jusqu'à 30% en poids.

Le PDGdeux peut être facilement obtenu en chauffant l'hydroxyde de cérium (III), Ce (OH) dans l'air ou l'oxygène3, ou tout sel de cérium (III), tel que l'oxalate, le carbonate ou le nitrate.
Le PDGdeux La stoechiométrie peut être obtenue par réaction à haute température de l'oxyde de cérium (III) avec de l'oxygène élémentaire. L'oxygène doit être en excès et un temps suffisant doit être laissé pour achever la conversion des différentes phases non stoechiométriques en cours de formation..
Ces phases comprennent des produits multicolores de formule CeOX (où x varie entre 1,5 et 2,0). Ils sont également appelés CeO2 x, où x peut avoir une valeur allant jusqu'à 0,3. Le PDGdeux C'est la forme de Ce la plus largement utilisée dans l'industrie. Il a une classification de faible toxicité, en particulier en raison de sa faible solubilité dans l'eau..

Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Dureté Mohs
- 3.3 Poids moléculaire
- 3.4 Point de fusion
- 3.5 Densité
- 3.6 Solubilité
- 3.7 Indice de réfraction
- 3.8 Autres propriétés
- 4 utilisations
- 4.1 - Dans l'industrie métallurgique
- 4.2 - Dans l'industrie du verre
- 4.3 - Dans les émaux
- 4.4 - En céramique zircone
- 4.5 - Dans les catalyseurs pour le contrôle des émissions des véhicules
- 4.6 - En catalyse des réactions chimiques
- 4.7 - Dans les applications biologiques et biomédicales
- 4.8 - Autres utilisations
- 5 Références
Structure
L'oxyde de cérium (IV) stoechiométrique cristallise dans le réseau cubique de type fluorite (CaFdeux), avec 8 ions Odeux- dans une structure cubique coordonnée avec 4 ions Ce4+.
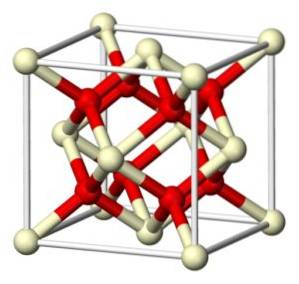
Nomenclature
- Oxyde de cérium (IV).
- Oxyde cérique.
- Dioxyde de cérium.
- Ceria.
- Oxyde de cérium stoechiométrique: matériau entièrement constitué de CeOdeux.
- Oxyde de cérium non stoechiométrique: matériau formé par des oxydes mixtes de CeOdeux jusqu'au CeO1,5
Propriétés
État physique
Solide jaune pâle. La couleur est sensible à la stoechiométrie et à la présence d'autres lanthanides. Les oxydes non stoechiométriques sont souvent bleus.
Dureté Mohs
6-6.1 environ.
Poids moléculaire
172,12 g / mol.
Point de fusion
2600 ºC environ.
Densité
7,132 g / cm3
Solubilité
Insoluble dans l'eau chaude et froide. Soluble dans l'acide sulfurique concentré et l'acide nitrique concentré. Insoluble dans les acides dilués.
Indice de réfraction
2.2.
Autres propriétés
Le PDGdeux C'est une substance inerte, elle n'est pas attaquée par des acides forts ou des alcalis. Cependant, il peut être dissous par des acides en présence d'agents réducteurs, comme le peroxyde d'hydrogène (HdeuxOU ALORSdeux) ou d'étain (II), entre autres, générant des solutions de cérium (III).
Il a une stabilité thermique élevée. Ne subit pas de changements cristallographiques pendant les intervalles de chauffage habituels.
Son dérivé hydraté (CeOdeux.nHdeuxO) est un précipité jaune et gélatineux obtenu en traitant des solutions de cérium (IV) avec des bases.
Le PDGdeux il est mal absorbé par le tractus gastro-intestinal et n'a donc aucun effet toxique.
Applications
- Dans l'industrie métallurgique
Le PDGdeux utilisé sur les électrodes de certaines technologies de soudage, telles que le soudage à l'arc au tungstène sous gaz inerte.
L'oxyde est finement dispersé dans toute la matrice de tungstène. À basse tension, ces particules de CeOdeux donnent une plus grande fiabilité que le tungstène seul.
- Dans l'industrie du verre
Polissage du verre
L'oxyde de cérium est l'agent de polissage le plus efficace pour la plupart des compositions de verre commerciales. Le PDGdeux a presque complètement remplacé d'autres oxydes de polissage, tels que FedeuxOU ALORS3, silice et ZrOdeux, en raison de sa vitesse de polissage et de nettoyage plus élevées, qui augmentent à mesure que le degré de pureté de l'oxyde augmente.
Les produits de polissage pour verre du commerce à base de poudres d'oxyde de cérium ont des tailles de particules définies et une dispersibilité contrôlée dans des systèmes aqueux..
Le processus de polissage du verre nécessite de l'eau et ce qui est enlevé ou reformé est une couche de surface hydratée plus douce. L'agent de polissage doit avoir une dureté Mohs d'environ 6,5, proche de la dureté de la plupart des verres.
L'oxyde de cérium dans l'eau contient le couple Ce (IV) / Ce (III) qui, grâce à ses réactions d'oxydoréduction, peut apporter une assistance chimique lors de la décomposition du réseau de silicate de verre.
Le PDGdeux avec un haut degré de pureté, il est utilisé pour traiter les miroirs, les téléviseurs, les lentilles ophtalmiques et les matériaux optiques de précision.
Décoloration du verre
Le PDGdeux peut décolorer le verre sodocalcique des bouteilles, cruches et autres. Ce (IV) oxyde les impuretés Fe (II), qui donnent une couleur vert bleuâtre, en Fe (III) qui donne une couleur jaune 10 fois plus faible.
Verre résistant aux radiations
L'ajout de 1% CeOdeux tout verre supprime la décoloration ou l'assombrissement du verre causé par le bombardement d'électrons à haute énergie dans les lunettes de télévision. Il en va de même pour le verre utilisé dans les fenêtres des cellules chaudes de l'industrie nucléaire, car il supprime la décoloration induite par les rayons gamma..
On pense que le mécanisme de suppression dépend de la présence d'ions Ce4+ et Ce3+ dans le filet de verre.
Lunettes photosensibles
Certaines formulations de verre peuvent développer des images latentes qui peuvent ensuite être converties en une structure ou une couleur permanente..
Ce type de verre contient du CeOdeux qui absorbe le rayonnement UV et libère des électrons dans la matrice de verre.
Après le traitement, la croissance de cristaux d'autres composés dans le verre est générée, créant des motifs détaillés pour des utilisations électroniques ou décoratives..
- En émaux
En raison de son indice de réfraction élevé, CeOdeux est un agent opacifiant dans les compositions d'émail utilisées comme revêtements protecteurs sur les métaux.
Sa stabilité thermique élevée et sa forme cristallographique unique sur toute la plage de températures atteintes pendant le processus de vitrage, le rendent approprié pour une utilisation dans les émaux de porcelaine..
Dans cette application, le PDGdeux Fournit le revêtement blanc souhaité pendant l'épuisement de l'émail. C'est l'ingrédient qui apporte l'opacité.
- En céramique de zirconium
La céramique de zirconium est un isolant thermique et est utilisée dans les applications à haute température. Il faut un additif pour avoir une résistance et une ténacité élevées. Ajout du PDGdeux L'oxyde de zirconium produit un matériau d'une ténacité exceptionnelle et d'une bonne résistance.
Oxyde de zirconium dopé au CeOdeux utilisé dans les revêtements pour agir comme barrière thermique sur les surfaces métalliques.
Par exemple, dans les pièces de moteurs d'avion, ces revêtements protègent des températures élevées auxquelles les métaux seraient exposés..
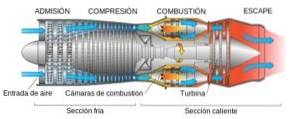
- Dans les catalyseurs pour le contrôle des émissions des véhicules
Le PDGdeux C'est un composant actif dans l'élimination des polluants des émissions des véhicules. Cela est en grande partie dû à sa capacité à stocker ou à libérer de l'oxygène en fonction des conditions qui l'entourent..
Le convertisseur catalytique des véhicules automobiles est situé entre le moteur et la sortie des gaz d'échappement. Il a un catalyseur qui doit oxyder les hydrocarbures imbrûlés, convertir le CO en COdeux, et réduire les oxydes d'azote, NONX, tonnedeux jedeux.

Outre le platine et d'autres métaux catalytiques, le principal composant actif de ces systèmes multifonctionnels est CeOdeux.
Chaque pot catalytique contient 50-100 g de CeOdeux finement divisé, qui remplit plusieurs fonctions. Les plus importants sont:
Agit comme un stabilisant pour l'alumine de grande surface
L'alumine à grande surface spécifique a tendance à fritter, perdant sa grande surface pendant le fonctionnement à haute température. Ceci est retardé par la présence de CeOdeux.
Il se comporte comme un libérateur de tampon d'oxygène
En raison de sa capacité à former des oxydes non stoechiométriques CeO2 x, l'oxyde de cérium (IV) fournit l'oxygène élémentaire de sa propre structure pendant la période de cycle pauvre en oxygène / riche en combustible.
Ainsi, l'oxydation des hydrocarbures imbrûlés provenant du moteur et la conversion du CO en CO peuvent se poursuivre.deux, même lorsque l'oxygène gazeux est insuffisant.
Puis, en période de cycle riche en oxygène, il reprend l'oxygène et se réoxyde, récupérant sa forme stoechiométrique CeOdeux.
Autres
Il agit comme un amplificateur de la capacité catalytique du rhodium dans la réduction des oxydes d'azote NOX à l'azote et à l'oxygène.
- En catalyse des réactions chimiques
Dans les procédés de craquage catalytique des raffineries, CeOdeux agit comme un oxydant catalytique qui aide à la conversion du SOdeux à SO3 et favorise la formation de sulfates dans des pièges spécifiques du procédé.
Le PDGdeux améliore l'activité du catalyseur à base d'oxyde de fer utilisé pour obtenir du styrène à partir d'éthylbenzène. Ceci est probablement dû à l'interaction positive entre les paires oxyde-réduction Fe (II) - Fe (III) et Ce (III) - Ce (IV).
- Dans les applications biologiques et biomédicales
Des nanoparticules de CeO ont été trouvéesdeux agissent en piégeant les radicaux libres, tels que le superoxyde, le peroxyde d'hydrogène, les radicaux hydroxyle et oxyde nitrique.
Ils peuvent protéger les tissus biologiques des dommages induits par les radiations, des dommages rétiniens induits par le laser, augmenter la durée de vie des cellules photoréceptrices, réduire les lésions de la colonne vertébrale, réduire l'inflammation chronique et favoriser l'angiogenèse ou la formation de vaisseaux sanguins.
De plus, certaines nanofibres contenant des nanoparticules de CeOdeux se sont avérés toxiques contre les souches bactériennes, étant des candidats prometteurs pour des applications bactéricides.
- Autres utilisations
Le PDGdeux C'est un matériau isolant électrique en raison de son excellente stabilité chimique, de sa permittivité relative élevée (il a une forte tendance à se polariser lorsqu'un champ électrique est appliqué) et d'un réseau cristallin similaire au silicium..
Il a trouvé une application dans les condensateurs et les couches d'amortissement de matériaux supraconducteurs.
Il est également utilisé dans les capteurs de gaz, les matériaux d'électrode de pile à combustible à oxyde solide, les pompes à oxygène et les moniteurs d'oxygène..
Les références
- Cotton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley et fils.
- Bailar, J. C.; Emeléus, H.J.; Sir Ronald Nyholm et Trotman-Dickenson, A.F. (1973). Chimie inorganique complète. Volume 4. Pergamon Press.
- Kirk-Othmer (1994). Encyclopédie de la technologie chimique. Volume 5. Quatrième édition. John Wiley et fils.
- Encyclopédie Ullmann de chimie industrielle. (1990). Cinquième édition. Volume A6. VCH Verlagsgesellschaft mbH.
- Casals, Eudald et coll. (2012). Analyse et risque des nanomatériaux dans les échantillons environnementaux et alimentaires. En chimie analytique complète. Récupéré de sciencedirect.com.
- Mailadil T. Sebastian. (2008). Alumine, Titania, Ceria, Silicate, Tungstate et autres matériaux. Dans les matériaux diélectriques pour la communication sans fil. Récupéré de sciencedirect.com.
- Afeesh Rajan Unnithan et coll. (2015). Échafaudages aux propriétés antibactériennes. Dans les applications de nanotechnologie pour l'ingénierie tissulaire. Récupéré de sciencedirect.com.
- Gottardi V. et coll. (1979). Polissage de la surface d'un verre étudié avec une technique nucléaire. Bulletin de la Société espagnole de céramique et de verre, volume 18, n ° 3. Récupéré de boletines.secv.es.



Personne n'a encore commenté ce post.