
Structure, propriétés et utilisations de l'oxyde d'or (III) (Au2O3)
le oxyde d'or (III) est un composé inorganique dont la formule chimique est AudeuxOU ALORS3. Théoriquement, on pourrait s'attendre à ce que sa nature soit de type covalent. Cependant, la présence d'un certain caractère ionique dans son solide ne peut être totalement exclue; ou ce qui est pareil, supposons l'absence du cation Au3+ à côté de l'anion Odeux-.
Il peut sembler contradictoire que l'or, étant un métal noble, puisse rouiller. Dans des conditions normales, les pièces d'or (comme les étoiles dans l'image ci-dessous) ne peuvent pas être oxydées par contact avec l'oxygène de l'atmosphère; cependant, lorsqu'il est irradié avec un rayonnement ultraviolet en présence d'ozone, OU3, le panorama est différent.

Si les étoiles d'or étaient soumises à ces conditions, elles prendraient une couleur brun rougeâtre, caractéristique de AudeuxOU ALORS3.
D'autres méthodes pour obtenir cet oxyde impliqueraient le traitement chimique desdites étoiles; par exemple, en convertissant la masse d'or en son chlorure respectif, AuCl3.
Puis à AuCl3, et le reste des éventuels sels d'or formés, un milieu basique fort est ajouté; et avec cela, on obtient l'oxyde ou l'hydroxyde hydraté, Au (OH)3. Enfin, ce dernier composé est déshydraté thermiquement pour obtenir AudeuxOU ALORS3.
Index des articles
- 1 Structure de l'oxyde d'or (III)
- 1.1 Aspects électroniques
- 1.2 Hydrate
- 2 propriétés
- 2.1 Apparence physique
- 2.2 Masse moléculaire
- 2.3 Densité
- 2.4 Point de fusion
- 2.5 Stabilité
- 2.6 Solubilité
- 3 Nomenclature
- 4 utilisations
- 4.1 Teinture du verre
- 4.2 Synthèse des aurates et de l'or fulminant
- 4.3 Manipulation des monocouches auto-assemblées
- 5 Références
Structure de l'oxyde d'or (III)
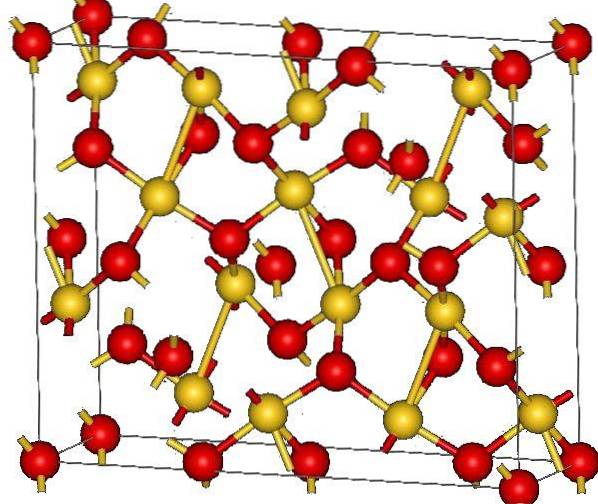
L'image du haut montre la structure cristalline de l'oxyde d'or (III). L'agencement des atomes d'or et d'oxygène dans le solide est montré, soit en les considérant comme des atomes neutres (solide covalent), soit des ions (solide ionique). Indifféremment, il suffit de supprimer ou de placer les liens Au-O dans tous les cas.
D'après l'image, on suppose que le caractère covalent prédomine (ce qui serait logique). Pour cette raison, les atomes et les liaisons représentés par des sphères et des barres, respectivement, sont indiqués. Les sphères d'or correspondent aux atomes d'or (AuIII-O), et les rougeâtres aux atomes d'oxygène.
Si vous regardez de plus près, vous verrez qu'il y a des unités AuO4, qui sont joints par des atomes d'oxygène. Une autre façon de le visualiser serait de considérer que chaque Au3+ est entouré de quatre Odeux-; bien sûr, d'un point de vue ionique.
Cette structure est cristalline car les atomes sont disposés selon le même schéma à longue portée. Ainsi, sa maille unitaire correspond au système cristallin rhomboédrique (le même dans l'image du haut). Par conséquent, tous les AudeuxOU ALORS3 pourrait être construit si toutes ces sphères de la cellule unitaire étaient distribuées dans l'espace.
Aspects électroniques
L'or est un métal de transition et ses orbitales 5d devraient interagir directement avec les orbitales 2p de l'atome d'oxygène. Ce chevauchement de leurs orbitales devrait théoriquement générer des bandes de conduction, qui convertiraient AudeuxOU ALORS3 dans un semi-conducteur solide.
Par conséquent, la véritable structure de AudeuxOU ALORS3 c'est encore plus complexe dans cet esprit.
Hydrate
L'oxyde d'or peut retenir les molécules d'eau dans ses cristaux rhomboédriques, donnant naissance à des hydrates. Lorsque de tels hydrates se forment, la structure devient amorphe, c'est-à-dire désordonnée.
La formule chimique de ces hydrates peut être l'une des suivantes, qui en fait ne sont pas entièrement clarifiées: AudeuxOU ALORS3∙ zHdeuxO (z = 1, 2, 3, etc.), Au (OH)3, ou AuXOU ALORSOui(OH)z.
La formule Au (OH)3 représente une simplification excessive de la véritable composition desdits hydrates. En effet, dans l'hydroxyde d'or (III), les chercheurs ont également trouvé la présence d'AudeuxOU ALORS3; et par conséquent, cela n'a aucun sens de le traiter isolément comme un hydroxyde de métal de transition «simple».
Par contre, à partir d'un solide de formule AuXOU ALORSOui(OH)z on pouvait s'attendre à une structure amorphe; puisque, cela dépend des coefficients X, Oui Oui z, dont les variations donneraient naissance à toutes sortes de structures qui pourraient difficilement présenter un motif cristallin.
Propriétés
Apparence physique
C'est un solide brun rougeâtre.
Masse moléculaire
441,93 g / mol.
Densité
11,34 g / mL.
Point de fusion
Fond et se décompose à 160 ° C. Par conséquent, il n'a pas de point d'ébullition, de sorte que cet oxyde n'atteint jamais le point d'ébullition..
Stabilité
AUdeuxOU ALORS3 il est thermodynamiquement instable car, comme mentionné au début, l'or n'a pas tendance à s'oxyder dans des conditions de température normales. Il est donc facilement réduit pour redevenir l'or noble.
Plus la température est élevée, plus la réaction est rapide, ce que l'on appelle la décomposition thermique. Ainsi, l'AudeuxOU ALORS3 à 160 ° C, il se décompose pour produire de l'or métallique et libérer de l'oxygène moléculaire:
2 AudeuxOU ALORS3 => 4 Au + 3 Odeux
Une réaction très similaire peut se produire avec d'autres composés qui favorisent ladite réduction. Pourquoi la réduction? Parce que l'or retrouve les électrons que l'oxygène lui a pris; ce qui revient à dire qu'il perd des liaisons avec l'oxygène.
Solubilité
C'est un solide insoluble dans l'eau. Cependant, il est soluble dans l'acide chlorhydrique et l'acide nitrique, en raison de la formation de chlorures d'or et de nitrates..
Nomenclature
L'oxyde d'or (III) est le nom régi par la nomenclature du stock. D'autres façons de le mentionner sont:
-Nomenclature traditionnelle: oxyde aurique, car la valence 3+ est la plus élevée pour l'or.
-Nomenclature systématique: trioxyde de dioro.
Applications
Coloration du verre
L'une de ses utilisations les plus éminentes est d'ajouter une couleur rougeâtre à certains matériaux, comme le verre, en plus de conférer certaines propriétés inhérentes aux atomes d'or..
Synthèse des aurates et de l'or fulminant
Si Au est ajoutédeuxOU ALORS3 dans un milieu où il est soluble, et en présence de métaux, les aurates peuvent précipiter après l'addition d'une base forte; qui sont formés par des anions AuO4- en compagnie de cations métalliques.
Aussi, l'AudeuxOU ALORS3 réagit avec l'ammoniac pour former le composé d'or fulminant, AudeuxOU ALORS3(NH3)4. Son nom vient du fait qu'il est hautement explosif.
Manipulation de monocouches auto-assemblées
Certains composés, tels que les disulfures de dialkyle, RSSR, ne sont pas adsorbés de la même manière sur l'or et son oxyde. Lorsque cette adsorption se produit, une liaison Au-S se forme spontanément, où l'atome de soufre présente et définit les caractéristiques chimiques de ladite surface en fonction du groupe fonctionnel auquel il est attaché..
Les RSSR ne peuvent pas être adsorbés sur AudeuxOU ALORS3, mais oui sur l'or métallique. Par conséquent, si la surface de l'or est modifiée et son degré d'oxydation, ainsi que la taille des particules ou couches d'AudeuxOU ALORS3, une surface plus hétérogène peut être conçue.
Cette surface AudeuxOU ALORS3-AuSR interagit avec les oxydes métalliques de certains appareils électroniques, développant ainsi de futures surfaces plus intelligentes.
Les références
- Wikipédia. (2018). Oxyde d'or (III). Récupéré de: en.wikipedia.org
- Formulation chimique. (2018). Oxyde d'or (III). Récupéré de: formulacionquimica.com
- D. Michaud. (2016, 24 octobre). Oxydes d'or. 911 métallurgiste. Récupéré de: 911metallurgist.com
- Shi, R. Asahi et C. Stampfl. (2007). Propriétés des oxydes d'or AudeuxOU ALORS3 et AudeuxOu: enquête sur les premiers principes. L'American Physical Society.
- Cook, Kevin M. (2013). L'oxyde d'or comme couche de masquage pour la chimie de surface régiosélective. Thèses et mémoires. Papier 1460.



Personne n'a encore commenté ce post.