
Structure, propriétés et utilisations de l'oxyde d'argent (Ag2O)
le oxyde d'argent est un composé inorganique dont la formule chimique est AgdeuxO. La force qui lie ses atomes est de nature entièrement ionique; il s'agit donc d'un solide ionique où il y a une proportion de deux cations Ag+ interagissant électrostatiquement avec un anion Odeux-.
L'anion oxyde, Odeux-, Il résulte de l'interaction des atomes d'argent en surface avec l'oxygène de l'environnement. de la même manière que le fer et de nombreux autres métaux. Au lieu de rougir et de s'effriter en rouille, un morceau ou un bijou d'argent devient noir, caractéristique de l'oxyde d'argent..

Par exemple, dans l'image ci-dessus, vous pouvez voir une coupe en argent oxydé. Notez sa surface noircie, bien qu'elle conserve encore un peu de lustre ornemental; c'est pourquoi même les objets en argent oxydé peuvent être considérés comme suffisamment attrayants pour des utilisations décoratives.
Les propriétés de l'oxyde d'argent sont telles qu'elles ne rongent pas, à première vue, la surface métallique d'origine. Il se forme à température ambiante par simple contact avec l'oxygène de l'air; et encore plus intéressant, il peut se décomposer à des températures élevées (au-dessus de 200 ° C).
Cela signifie que si le verre de l'image était saisi et que la chaleur d'une flamme intense lui était appliquée, il retrouverait ses lueurs argentées. Par conséquent, sa formation est un processus thermodynamiquement réversible..
L'oxyde d'argent possède également d'autres propriétés et, au-delà de sa formule simple AgdeuxOu, il englobe des organisations structurelles complexes et une riche variété de solides. Cependant, l'AgdeuxOu est-ce peut-être, à côté de l'AgdeuxOU ALORS3, le plus représentatif des oxydes d'argent.
Index des articles
- 1 Structure de l'oxyde d'argent
- 1.1 Changements avec le numéro de valence
- 2 Propriétés physiques et chimiques
- 2.1 Poids moléculaire
- 2.2 Apparence
- 2.3 Densité
- 2.4 Point de fusion
- 2,5 Kps
- 2.6 Solubilité
- 2.7 Caractère covalent
- 2.8 Décomposition
- 3 Nomenclature
- 3.1 Valencias I et III
- 3.2 Nomenclature systématique des oxydes d'argent complexes
- 4 utilisations
- 5 Références
Structure de l'oxyde d'argent
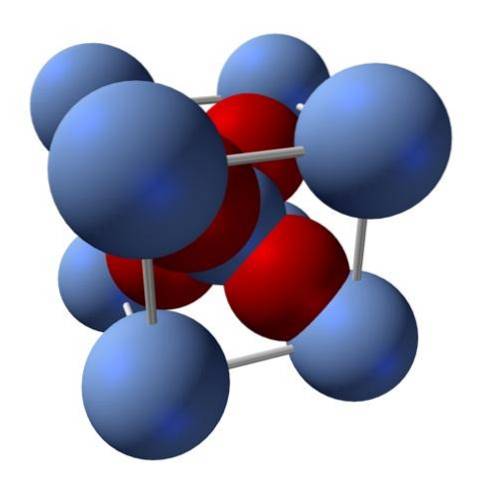
Comment est sa structure? Comme mentionné au début: c'est un solide ionique. Pour cette raison, il ne peut y avoir ni liaison covalente Ag - O ni Ag = O dans sa structure; car, s'il y en avait, les propriétés de cet oxyde changeraient radicalement. C'est alors les ions Ag+ jedeux- dans un rapport 2: 1 et subissant une attraction électrostatique.
La structure de l'oxyde d'argent est par conséquent déterminée par la manière dont les forces ioniques arrangent les ions Ag dans l'espace.+ jedeux-.
Dans l'image ci-dessus, par exemple, il y a une cellule unitaire pour un système cristallin cubique: les cations Ag+ sont les sphères bleu argenté, et le Odeux- les sphères rougeâtres.
Si l'on compte le nombre de sphères, on constatera qu'il y en a, à l'œil nu, neuf bleu argenté et quatre rouges. Cependant, seuls les fragments des sphères contenues dans le cube sont considérés; en les comptant, étant des fractions des sphères totales, le rapport 2: 1 pour Ag doit être respectédeuxOU ALORS.
Répétition de l'unité structurelle du tétraèdre AgO4 entouré de quatre autres Ag+, tout le solide noir est construit (en évitant les lacunes ou les irrégularités que ces arrangements cristallins peuvent avoir).
Changements avec le numéro de valence
Se concentrer maintenant pas sur le tétraèdre AgO4 mais sur la ligne AgOAg (observer les sommets du cube supérieur), on verra que le solide d'oxyde d'argent est constitué, dans une autre perspective, de multiples couches d'ions disposées linéairement (bien qu'inclinées). Tout cela grâce à la géométrie "moléculaire" autour de Ag+.
Ceci a été corroboré par plusieurs études de sa structure ionique..
L'argent fonctionne principalement avec la valence +1, car lors de la perte d'un électron, sa configuration électronique résultante est [Kr] 4ddix, ce qui est très stable. Autres valences, telles que Agdeux+ et Ag3+ ils sont moins stables car ils perdent des électrons à partir d'orbitales d presque pleines.
L'ion Ag3+, cependant, il est relativement moins instable que Agdeux+. En fait, il peut coexister en compagnie d'Ag+ enrichir chimiquement la structure.
Sa configuration électronique est [Kr] 4d8, avec des électrons non appariés de manière à lui donner une certaine stabilité.
Contrairement aux géométries linéaires autour des ions Ag+, il a été constaté que celui des ions Ag3+ c'est un plan carré. Par conséquent, un oxyde d'argent avec des ions Ag3+ serait constitué de couches composées de carrés de AgO4 (pas tétraèdres) liés électrostatiquement par des lignes AgOAg; tel est le cas de Ag4OU ALORS4 ou AgdeuxO ∙ AgdeuxOU ALORS3 à structure monoclinique.
Proprietes physiques et chimiques

Le grattage de la surface de la coupe en argent dans l'image principale donnerait un solide, qui n'est pas seulement de couleur noire, mais a également des nuances de brun ou de brun (image du haut). Certaines de ses propriétés physiques et chimiques rapportées pour le moment sont les suivantes:
Poids moléculaire
231,735 g / mol
Apparence
Solide brun noir sous forme de poudre (notez que bien qu'il s'agisse d'un solide ionique, il n'a pas d'aspect cristallin). Il est inodore et mélangé à de l'eau lui donne un goût métallique
Densité
7,14 g / mL.
Point de fusion
277 à 300 ° C Certes, il fond en argent massif; c'est-à-dire qu'il se décompose probablement avant de former l'oxyde liquide.
Kps
1,52 ∙ 10-8 dans l'eau à 20 ° C C'est donc un composé difficilement soluble dans l'eau.
Solubilité
Si vous regardez de près l'image de sa structure, vous constaterez que les sphères d'Agdeux+ jedeux- ils ne diffèrent pas presque en taille. Il en résulte que seules de petites molécules peuvent traverser l'intérieur du réseau cristallin, ce qui le rend insoluble dans presque tous les solvants; sauf ceux où il réagit, comme les bases et les acides.
Caractère covalent
Bien que l'oxyde d'argent ait été répété à plusieurs reprises comme étant un composé ionique, certaines propriétés, telles que son bas point de fusion, contredisent cette affirmation..
Certes, la prise en compte du caractère covalent ne détruit pas ce qui a été expliqué pour sa structure, puisqu'il suffirait d'ajouter dans la structure de AgdeuxOu un modèle de sphères et de barres pour indiquer les liaisons covalentes.
De même, les tétraèdres et les plans carrés AgO4, ainsi que les lignées AgOAg, elles seraient liées par des liaisons covalentes (ou covalentes ioniques).
Dans cet esprit, l'AgdeuxOu ce serait en fait un polymère. Cependant, il est recommandé de le considérer comme un solide ionique à caractère covalent (dont la nature de la liaison est encore aujourd'hui un défi).
Décomposition
Au début, il a été mentionné que sa formation est thermodynamiquement réversible, de sorte qu'il absorbe la chaleur pour revenir à son état métallique. Tout cela peut être exprimé par deux équations chimiques pour de telles réactions:
4Ag (s) + Odeux(g) => 2AgdeuxO (s) + Q
2AgdeuxO (s) + Q => 4Ag (s) + Odeux(g)
Où Q représente la chaleur dans l'équation. Ceci explique pourquoi le feu brûlant la surface de la coupe en argent oxydé lui redonne sa lueur argentée..
Par conséquent, il est difficile de supposer qu'il y a AgdeuxO (l) car il se décomposerait instantanément à cause de la chaleur; Sauf si la pression est trop élevée pour obtenir ledit liquide brun noir.
Nomenclature
Quand la possibilité d'ions Ag a été introduitedeux+ et Ag3+ en plus de l'Ag commun et prédominant+, le terme `` oxyde d'argent '' commence à paraître insuffisant pour désigner AgdeuxOU ALORS.
C'est parce que l'ion Ag+ est plus abondant que les autres, donc l'Ag est prisdeuxOu comme seul oxyde; ce qui n'est pas correct du tout.
Si Agdeux+ comme il est pratiquement inexistant compte tenu de son instabilité, nous n'aurons que les ions de valences +1 et +3; c'est-à-dire Ag (I) et Ag (III).
Valencias I et III
Comme Ag (I) est celui avec la valence la plus basse, il est nommé en ajoutant le suffixe -oso à son nom argentum. Ainsi l'AgdeuxSoit c'est: oxyde d'argent ou, selon la nomenclature systématique, monoxyde diplate.
Si Ag (III) est complètement ignoré, alors sa nomenclature traditionnelle devrait être: oxyde d'argent au lieu d'oxyde d'argent.
En revanche, Ag (III) étant la valence la plus élevée, le suffixe -ico est ajouté à son nom. Ainsi l'AgdeuxOU ALORS3 est: oxyde d'argent (2 ions Ag3+ avec trois Odeux-). Aussi, son nom selon la nomenclature systématique serait: trioxyde de diplata.
Si la structure de AgdeuxOU ALORS3, on peut présumer qu'il s'agit du produit de l'oxydation par l'ozone, OU3, au lieu de l'oxygène. Par conséquent, son caractère covalent doit être plus grand car il s'agit d'un composé covalent avec des liaisons Ag-O-O-O-Ag ou Ag-O.3-Ag.
Nomenclature systématique des oxydes d'argent complexes
L'AgO, également écrit comme Ag4OU ALORS4 ou AgdeuxO ∙ AgdeuxOU ALORS3, C'est un oxyde d'argent (I, III), car il a à la fois +1 et +3 valences. Son nom selon la nomenclature systématique serait: tétra-tétraoxyde d'argent.
Cette nomenclature est d'une grande utilité lorsqu'il s'agit d'autres oxydes d'argent stoechiométriquement complexes. Par exemple, supposons que les deux solides 2AgdeuxO ∙ AgdeuxOU ALORS3 et AgdeuxO ∙ 3AgdeuxOU ALORS3.
Ecrire le premier de manière plus appropriée serait: Ag6OU ALORS5 (comptage et addition des atomes d'Ag et d'O). Son nom serait alors le pentoxyde d'hexaplate. A noter que cet oxyde a une composition en argent moins riche que l'AgdeuxOu (6: 5 < 2:1).
En écrivant le deuxième solide d'une autre manière, ce serait: Ag8OU ALORSdix. Son nom serait décaoxyde d'octa-argent (avec un rapport 8:10 ou 4: 5). Cet oxyde d'argent hypothétique serait "très oxydé".
Applications
Les études à la recherche d'utilisations nouvelles et sophistiquées de l'oxyde d'argent se poursuivent à ce jour. Certaines de ses utilisations sont énumérées ci-dessous:
-Il se dissout dans l'ammoniac, le nitrate d'ammonium et l'eau pour former le réactif de Tollens. Ce réactif est un outil utile dans l'analyse qualitative au sein des laboratoires de chimie organique. Il permet de déterminer la présence d'aldéhydes dans un échantillon, avec la formation d'un "miroir d'argent" dans l'éprouvette en réponse positive..
-Avec le zinc métallique, il forme les principales batteries à l'oxyde de zinc-argent. C'est peut-être l'une de ses utilisations les plus courantes et à la maison.
-Il sert d'épurateur de gaz, absorbant par exemple du COdeux. Lorsqu'il est chauffé, il libère des gaz piégés et peut être réutilisé plusieurs fois.
-En raison des propriétés antimicrobiennes de l'argent, son oxyde est utile dans les études de bioanalyse et de purification des sols..
-C'est un agent oxydant doux capable d'oxyder les aldéhydes en acides carboxyliques. Il est également utilisé dans la réaction de Hofmann (des amines tertiaires) et participe à d'autres réactions organiques, soit comme réactif, soit comme catalyseur..
Les références
- Bergstresser M. (2018). Oxyde d'argent: formule, décomposition et formation. Étude. Récupéré de: study.com
- Auteurs et éditeurs des volumes III / 17E-17F-41C. (s.f.). Structure cristalline des oxydes d'argent (Ag (x) O (y)), paramètres du réseau. (Données numériques et relations fonctionnelles en science et technologie), vol 41C. Springer, Berlin, Heidelberg.
- Mahendra Kumar Trivedi, Rama Mohan Tallapragada, Alice Branton, Dahryn Trivedi, Gopal Nayak, Omprakash Latiyal, Snehasis Jana. (2015). L'impact potentiel du traitement énergétique Biofield sur les propriétés physiques et thermiques de la poudre d'oxyde d'argent. Journal international de la science et de l'ingénierie biomédicales. Vol. 3, n ° 5, p. 62-68. doi: 10.11648 / j.ijbse.20150305.11
- Sullivan R. (2012). Décomposition de l'oxyde d'argent. Université de l'Oregon. Récupéré de: chemdemos.uoregon.edu
- Flint, Deyanda. (24 avril 2014). Utilisations des batteries à l'oxyde d'argent. Découvrir. Récupéré de: scaimer.com
- Salman Montasir E. (2016). Etude de certaines propriétés optiques de l'oxyde d'argent (Ag2o) à l'aide d'un spectrophotomètre UVVisible. [PDF]. Récupéré de: iosrjournals.org
- Le juge Bard Allen (1985). Potentiels standard en solution aqueuse. Marcel Dekker. Récupéré de: books.google.co.ve



Personne n'a encore commenté ce post.