
Formule d'oxyde perchlorique (Cl2O7), propriétés, risques

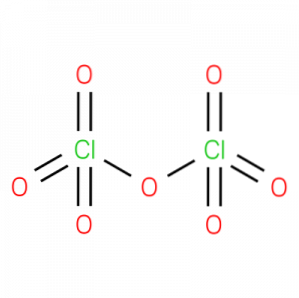
le oxyde perchlorique, également appelé oxyde de chlore (VII), anhydride perchlorique ou dichloroheptoxyde,est un composé chimique inorganique de formule CldeuxO7. Sa structure est présentée dans la figure 1.
C'est l'un des oxydes de chlore les plus stables et réagit avec l'eau pour produire de l'acide perchlorique: CldeuxOU ALORS7 + HdeuxO D 2HClO4.
Le composé est obtenu par déshydratation soigneuse de l'acide perchlorique avec du pentoxyde de phosphore à -10 ° C.
2HClO4 + PdeuxOU ALORS5 "CldeuxOU ALORS7 + 2HPO3
Le composé est distillé pour le séparer de l'acide métaphosphorique avec une extrême prudence étant donné sa nature explosive. Il peut également être formé par éclairage dans des mélanges de chlore et d'ozone.
Propriétés physiques et chimiques de l'oxyde perchlorique
L'oxyde de chlore (VII) est un liquide incolore, volatil et huileux. Son poids moléculaire est de 182,9 g / mol, sa densité de 1900 kg / m3 et ses points de fusion et d'ébullition sont respectivement de -91,57 ºC et 82 ºC..
Il est spontanément explosif au choc ou au contact de la flamme et notamment en présence de ses produits de décomposition..
L'heptoxyde de chlore se dissout dans le tétrachlorure de carbone à température ambiante et réagit avec l'eau pour former de l'acide perchlorique. Éclats au contact de l'iode.
Dans des conditions normales, il est plus stable, bien qu'avec moins de pouvoir oxydant que les autres oxydes de chlore. Par exemple, il n'attaque pas le soufre, le phosphore ou le papier lorsqu'il fait froid.
Le dichloroheptoxyde est un oxyde fortement acide et, en solution, il forme un équilibre avec l'acide perchlorique. Forme des perchlorates en présence d'hydroxydes de métaux alcalins.
Sa décomposition thermique est produite par la dissociation monomoléculaire du trioxyde de chlore et du radical
Réactivité et dangers
L'oxyde perchlorique est un composé instable. Se décompose lentement lors du stockage, avec la production de produits de décomposition colorés qui sont des oxydes de chlore inférieurs.
Il est spontanément explosif, notamment en présence de ses produits de décomposition, incompatible avec les agents réducteurs, les acides forts et les bases..
Bien que ce soit l'oxyde de chlore le plus stable, CldeuxOU ALORS7 C'est un oxydant fort, ainsi qu'un explosif qui peut être éteint avec une flamme ou un choc mécanique, ou par contact avec de l'iode..
Cependant, il est moins oxydant que les autres oxydes de chlore et n'attaque pas le soufre, le phosphore ou le papier à froid. A les mêmes effets sur le corps humain que le chlore élémentaire et nécessite les mêmes précautions
L'ingestion provoque de graves brûlures à la bouche, à l'œsophage et à l'estomac. La vapeur est très toxique par inhalation.
En cas de contact avec les yeux, vérifiez si vous portez des lentilles de contact et retirez-les immédiatement. Les yeux doivent être rincés à l'eau courante pendant au moins 15 minutes, en gardant les paupières ouvertes. De l'eau froide peut être utilisée. La pommade oculaire ne doit pas être utilisée.
Si le produit chimique entre en contact avec les vêtements, retirez-le le plus rapidement possible, en protégeant vos mains et votre corps. Placer la victime sous une douche de sécurité.
Si le produit chimique s'accumule sur la peau exposée de la victime, comme les mains, la peau contaminée est lavée doucement et soigneusement à l'eau courante et au savon non abrasif..
De l'eau froide peut être utilisée. Si l'irritation persiste, consulter un médecin. Lavez les vêtements contaminés avant de les réutiliser.
En cas d'inhalation, la victime doit être autorisée à se reposer dans un endroit bien ventilé. Si l'inhalation est sévère, la victime doit être évacuée vers une zone sûre dès que possible..
Desserrez les vêtements serrés comme un col de chemise, une ceinture ou une cravate. Si la victime a du mal à respirer, de l'oxygène doit être administré.
Si la victime ne respire pas, une réanimation bouche-à-bouche est effectuée. Gardez toujours à l'esprit qu'il peut être dangereux pour la personne aidant de pratiquer la réanimation bouche-à-bouche lorsque le produit inhalé est toxique, infectieux ou corrosif..
Dans tous les cas, consultez immédiatement un médecin.
Applications
L'oxyde perchlorique n'a pas d'applications pratiques. Il pourrait être utilisé comme agent oxydant ou pour la production d'acide perchlorique mais son caractère explosif le rend difficile à manipuler.
Le dichloroheptoxyde peut être utilisé comme réactif pour la production de perchlorates ou pour l'étude avec différentes réactions.
Dans les travaux de Kurt Baum, les réactions de l'oxyde perchlorique avec les oléfines (Baum, 1976), les alcools (Kurt Baum, Reactions of dichlorine heptoxide with alcools, 1974), les iodures d'alkyle et le perchlorate d'acyle avec l'ester (Kurt Baum, 1975) obtenant des halogénations et oxydations.
Dans le cas des alcools, il produit des perchlorates d'alkyle par réaction avec des alcools simples tels que l'éthylène glycol, le 1,4-butadiénol, le 2,2,2-trifluoroéthanol, le 2,2-dinitropropanol. Réagit avec le 2-propanol pour donner du perchlorate d'isopropyle. Le 2-hexanol et le 3-hexanol donnent des perchlorates non adressés et leurs cétones respectives.
Le propène réagit avec le dichloroheptoside dans le tétrachlorure de carbone pour donner du perchlorate d'isopropyle (32%) et du 1-chloro, 2-propylperchlorate (17%). Le composé réagit avec cis-butène pour donner le perchlorate de 3-chlorobutyle (30%) et le perchlorate de 3-céto, 2-butyle (7%).
Le dichloroheptoxyde réagit avec les amines primaires et secondaires dans une solution de tétrachlorure de carbone pour donner des N-perchlorates:
2 RNH2 + Cl2O7 → 2 RNHClO3 + H2O
2 R2NH + Cl2O7 → 2 R2NClO3 + H2O
Il réagit également avec les alcènes pour donner des perchlorates d'alkyle. Par exemple, il réagit avec le propène dans une solution de tétrachlorure de carbone pour produire du perchlorate d'isopropyle et du perchlorate de 1-chloro-2-propyle (Beard et Baum, 1974)..
Les références
- Baum, K. (1976). Réactions de l'heptoxyde de dichlore avec les oléfines. Org. Chimie 41 (9) , 1663-1665.
- Beard, C. D., et Baum, K ... (1974). Réactions de l'heptoxyde de dichlore avec les amines. Journal de l'American Chemical Society. 96 (10), 3237-3239.
- Egon Wiberg, N. W. (2001). Chimie inorganique. Presse académique: Londres.
- EMBL-EBI. (2009, 25 avril). heptaoxyde de dichlore. Récupéré de ChEBI: ebi.ac.uk.
- Kurt Baum, C. D. (1974). Réactions de l'heptoxyde de dichlore avec les alcools. Am. Chem. Soc., 96 (10), 3233-3237.
- Kurt Baum, C. D. (1975). Réactions de l'heptoxyde de dichlore et des perchlorates d'acyle avec les éthers. Org. Chem., 40 (1) , 81-85.
- Kurt Baum, C. D. (1975). Réactions de l'heptoxyde de dichlore et des hypohalites avec les iodures d'alkyle. Org. Chem., 40 (17), 2536-2537.
- Société royale de chimie. (2015). Heptoxyde de dichlore. Récupéré de chemspider: chemspider.com.


Personne n'a encore commenté ce post.