
Formule d'oxyde plombeux (PbO), propriétés, risques et utilisations

le rouille d'aplomb, L'oxyde de plomb (II) ou monoxyde de plomb est un composé chimique de formule PbO. On le trouve dans deux polymorphes: la litharge et la masicotite. Sa structure est illustrée à la figure 1.
De retour à la composition, la litharge est le produit oxydé de plomb fondu qui a été agité ou atomisé pour incorporer de l'air, puis refroidi et broyé pour former la poudre jaune..
Le nom masicotite est utilisé à la fois pour le minéral natif et pour le monoxyde de plomb produit en chauffant le carbonate de plomb à 300 ° C (Monoxyde de plomb, 2016). Ces minéraux sont illustrés à la figure 2.

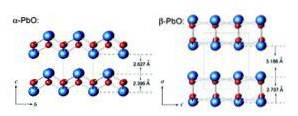
La masicotite a une structure orthorhombique tandis que la litharge a une structure cristalline tétragonale. L'oxyde de plomb (II) a la capacité de changer de structure lorsqu'il est chauffé ou refroidi. Ces structures sont illustrées à la figure 3.
Le PbO est produit en oxydant le plomb métallique. Le métal est fondu pour faire des comprimés de plomb, puis ils sont broyés entre 170 et 210 ° C et passés à travers la flamme pour l'oxydation à des températures supérieures à 600 ℃. Les produits oxydés sont broyés pour obtenir l'oxyde de plomb fini (Kirk-Othmer, 1995).
2Pb + O2 → 2PbO
Le PbO est produit à grande échelle comme intermédiaire dans le raffinage des minerais de plomb en plomb métallique. Le minéral de plomb utilisé est la galène (sulfure de plomb (II)). À haute température (1000 ° C), le sulfure est converti en oxyde comme suit:
2PbS + 3O2 → 2PbO + 2SO2
Index des articles
- 1 Propriétés physiques et chimiques de la rouille à plomb
- 2 Réactivité et dangers
- 3 utilisations
- 4 Références
Propriétés physiques et chimiques de l'oxyde plombeux
Le monoxyde de plomb peut présenter deux apparences différentes: sous forme de poudre sèche jaune à structure orthorhombique (masicotite) ou sous forme de cristaux tétragonaux rougeâtres (litharge). Les deux manières sont illustrées dans la figure 4.

Le composé a un poids moléculaire de 223,20 g / mol et une densité de 9,53 g / ml. Il a un point de fusion de 888 ° C et un point d'ébullition de 1470 ° C (National Center for Biotechnology Information, S.F.).
Le composé est très peu soluble dans l'eau, ne pouvant dissoudre que 0,0504 gramme par litre à 25 ° C sous forme de masicotite et 0,1065 gramme par litre à 25 ° C sous forme de litharge. Le composé est également insoluble dans l'alcool. Il est soluble dans l'acide acétique, le HNO3 dilué et les alcalis (Royal Society of Chemistry, 2015).
Le composé est un agent oxydant ou réducteur faible, cependant, des réactions d'oxydoréduction peuvent encore se produire. Ces composés ne réagissent pas à l'eau.
L'oxyde de plomb oxyde le carbure d'aluminium avec incandescence lorsqu'il est chauffé. Des mélanges d'oxyde de plomb avec de la poussière d'aluminium (comme avec d'autres métaux: sodium, zirconium) donnent une violente explosion.
Réactivité et dangers
Le monoxyde de plomb est un composé classé comme toxique. La substance est toxique pour le système nerveux central et peut être cancérigène chez l'homme (Fiche signalétique Oxyde de plomb, jaune, 2013).
Le symptôme précoce d'empoisonnement est constitué de lignes de plomb qui apparaissent sur le bord des gencives et la peau devient grise. Le syndrome neurasthénique apparaîtra également au cours de la période initiale d'envenimation..
L'intoxication cérébelleuse peut entraîner une dépression par empoisonnement au plomb, une manie par empoisonnement au plomb, ainsi qu'une toxicité par le plomb et une sensibilité à la paralysie de la névrite multiple.
Le saturnisme peut également provoquer une anémie hypochrome et des troubles endocriniens et métaboliques. De plus, le saturnisme peut inhiber l'activité de certaines enzymes du système digestif et provoquer une indigestion, de graves douleurs abdominales et des lésions hépatiques. Il peut également provoquer une hypertension artérielle et une augmentation du cholestérol..
En cas de douleur abdominale sévère, certaines mesures peuvent être prises telles que l'injection sous-cutanée d'atropine et d'autres médicaments, des abdominaux chauds, un lavement, un bain chaud, etc. La concentration maximale autorisée dans l'air est de 0,01 mg / m3 (monoxyde de plomb, 2016).
En cas de contact avec les yeux ou avec la peau, il doit être lavé à grande eau. En cas d'inhalation ou d'ingestion, la victime doit être emmenée dans un endroit ventilé. Les vomissements ne doivent pas être provoqués. Si la victime ne respire pas, une réanimation bouche-à-bouche doit être administrée.
Dans tous les cas, une attention médicale immédiate doit être recherchée. Le monoxyde de plomb est un composé nocif pour l'environnement, la bioaccumulation de ce produit chimique peut se produire chez les plantes et les mammifères.
Il est fortement recommandé que cette substance ne pénètre pas dans l'environnement, elle doit donc être manipulée et stockée conformément aux stipulations établies (National Institute for Occupational Safety and Health, 2015).
Applications
Le monoxyde de plomb a été utilisé comme dessiccateur de peinture et comme faible débit de feu dans la fabrication de céramiques et de verre. Le verre en cristal au plomb est utilisé dans la fabrication de vaisselle de haute qualité.
En utilisant du monoxyde de plomb comme fondant, il est possible d'obtenir un verre avec un indice de réfraction élevé et, par conséquent, la luminosité souhaitée (British Encyclopedia, 2016).
Les conducteurs céramiques semi-métalliques ont les conductivités les plus élevées de toutes les céramiques à l'exception des supraconducteurs. L'oxyde de plomb est un exemple de ce type de céramique semi-métallique. Ces matériaux ont des bandes d'énergie électronique qui se chevauchent et sont donc d'excellents conducteurs électroniques (Mason, 2008).
L'oxyde de plomb est principalement utilisé dans les tubes électroniques, les tubes à image, le verre optique, le verre au plomb anti-rayons X et les caoutchoucs résistants aux radiations..
Il est utilisé comme réactif analytique, le flux de silicate, mais aussi pour la précipitation d'acides aminés
L'oxyde de plomb est utilisé dans la fabrication de stabilisants en plastique PVC et est également la matière première pour d'autres sels de plomb. Il est également utilisé dans le raffinage du pétrole et pour la détermination de l'or et de l'argent..
Il est également utilisé comme pigment jaune dans les peintures et les émaux. La masicotite était utilisée comme pigment par les artistes du XVe au XVIIIe siècle.
De fines couches de monoxyde de plomb sont utilisées pour produire des couleurs irisées dans le laiton et le bronze. Litharge est mélangé avec du glycérol pour fabriquer du ciment de plombier.
Les références
- Encyclopédie Britannica. (2016, 10 octobre). Verre. Récupéré de britannica: britannica.com.
- Kirk-Othmer. (Année mille neuf cents quatre-vingts-quinze). Encyclopédie de la technologie chimique. 4e éd. Volumes 1. New York: John Wiley and Sons.
- Monoxyde de plomb. (2016, 1er mai). Récupéré de cameo.mfa: cameo.mfa.org.
- Monoxyde de plomb. (2016). Récupéré de Chemicalbook: Chemicalbook.com.
- Mason, T.O. (12 mars 2008). Céramiques conductrices. Récupéré de britannica: britannica.com.
- Fiche signalétique Oxyde de plomb, jaune. (2013, 21 mai). Récupéré de sciencelab: sciencelab.com.
- Centre national d'information sur la biotechnologie. (S.F.). Base de données des composés PubChem; CID = 14827. Récupéré de PubChem: pubchem.ncbi.nlm.nih.gov.
- Institut national pour la sécurité et la santé au travail. (2015, 22 juillet). OXYDE DE PLOMB (II). Récupéré de cdc.gov: cdc.gov.
- Société royale de chimie. (2015). Oxyde de plomb (II). Récupéré de chemspider: chemspider.com.



Personne n'a encore commenté ce post.