
Structure de l'acétate d'éthyle, propriétés, synthèse, utilisations
le acétate d'éthyle ou éthanoate d'éthyle (Nom IUPAC) est un composé organique dont la formule chimique est CH3COOCdeuxH5. Il se compose d'un ester, où le composant alcoolique dérive de l'éthanol, tandis que son composant acide carboxylique provient de l'acide acétique..
C'est un liquide dans des conditions normales de température et de pression, présentant un agréable arôme fruité. Cette propriété est parfaitement en harmonie avec ce que l'on attend d'un ester; qui est en fait la nature chimique de l'acétate d'éthyle. Pour cette raison, il est utilisé dans les produits alimentaires et les boissons alcoolisées..

L'image du haut montre la structure squelettique de l'acétate d'éthyle. Notez à gauche son composant acide carboxylique, et à droite le composant alcoolique. D'un point de vue structurel, on pourrait s'attendre à ce que ce composé se comporte comme un hybride entre le vinaigre et l'alcool; cependant, il présente ses propres propriétés.
C'est ici que ces hybrides appelés esters se distinguent par leur différence. L'acétate d'éthyle ne peut pas réagir comme un acide, ni être déshydraté en raison de l'absence d'un groupe OH. Au lieu de cela, il subit une hydrolyse basique en présence d'une base forte, telle que l'hydroxyde de sodium, NaOH.
Cette réaction d'hydrolyse est utilisée dans les laboratoires d'enseignement pour les expériences cinétiques chimiques; où la réaction est également de second ordre. Lors de l'hydrolyse, l'éthanoate d'éthyle revient pratiquement à ses composants initiaux: acide (déprotoné par NaOH) et alcool.
Dans son squelette structural, on observe que les atomes d'hydrogène prédominent sur les atomes d'oxygène. Cela influence leur capacité à interagir avec des espèces qui ne sont pas aussi polaires que les graisses. De même, il est utilisé pour dissoudre des composés tels que des résines, des colorants et en général des solides organiques..
Malgré un arôme agréable, une exposition prolongée à ce liquide a un impact négatif (comme presque tous les composés chimiques) sur le corps..
Index des articles
- 1 Structure de l'acétate d'éthyle
- 1.1 Absence d'atomes donneurs de liaison hydrogène
- 2 Propriétés physiques et chimiques
- 2.1 Noms
- 2.2 Formule moléculaire
- 2.3 Poids moléculaire
- 2.4 Description physique
- 2.5 Couleur
- 2.6 Odeur
- 2.7 Saveur
- 2.8 Seuil d'odeur
- 2.9 Point d'ébullition
- 2.10 Point de fusion
- 2.11 Solubilité dans l'eau
- 2.12 Solubilité dans les solvants organiques
- 2.13 Densité
- 2.14 Densité de vapeur
- 2.15 Stabilité
- 2.16 Pression de vapeur
- 2.17 Viscosité
- 2.18 Chaleur de combustion
- 2.19 Chaleur de vaporisation
- 2.20 Tension superficielle
- 2.21 Indice de réfraction
- 2.22 Température de stockage
- 2,23 pKa
- 3 Synthèse
- 3.1 Réaction de Fisher
- 3.2 Réaction de Tishchenko
- 3.3 Autres méthodes
- 4 utilisations
- 4.1 Solvant
- 4.2 Arômes artificiels
- 4.3 Analyse
- 4.4 Synthèses organiques
- 4.5 Chromatographie
- 4.6 Entomologie
- 5 risques
- 6 Références
Structure de l'acétate d'éthyle
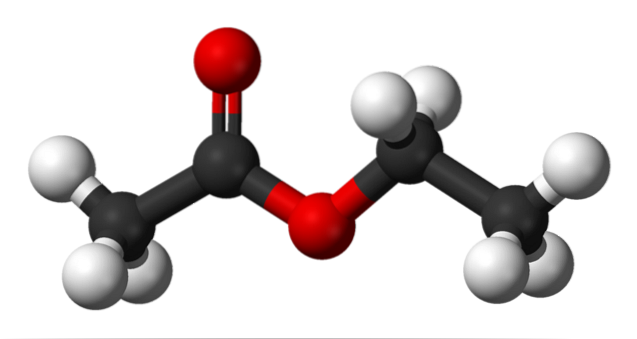
L'image du haut montre la structure de l'acétate d'éthyle avec un modèle de sphères et de barres. Dans ce modèle, les atomes d'oxygène sont mis en évidence avec des sphères rouges; à sa gauche la fraction dérivée de l'acide, et à sa droite la fraction dérivée de l'alcool (groupe alcoxy, -OR).
Le groupe carbonyle est vu par la liaison C = O (les doubles barres). La structure autour de ce groupe et de l'oxygène adjacent est plate, du fait qu'il y a une délocalisation de la charge par résonance entre les deux oxygènes; un fait qui explique une acidité relativement faible des hydrogènes α (ceux du groupe -CH3, lié à C = O).
En faisant tourner deux de ses liaisons, la molécule favorise directement la façon dont elle interagit avec d'autres molécules. La présence des deux atomes d'oxygène et l'asymétrie dans la structure lui confèrent un moment dipolaire permanent; qui à son tour est responsable de leurs interactions dipôle-dipôle.
Par exemple, la densité électronique est plus élevée près des deux atomes d'oxygène, diminuant considérablement dans le groupe -CH.3, et progressivement dans le groupe OCHdeuxCH3.
En raison de ces interactions, les molécules d'acétate d'éthyle forment un liquide dans des conditions normales, qui a un point d'ébullition considérablement élevé (77 ° C)..
Absence d'atomes donneurs de liaison hydrogène
Si vous regardez de près la structure, vous remarquerez l'absence d'un atome capable de donner une liaison hydrogène. Cependant, les atomes d'oxygène sont de tels accepteurs et, à cause de l'acétate d'éthyle, il est très soluble dans l'eau et interagit à un degré estimable avec les composés polaires et les donneurs de liaisons hydrogène (tels que les sucres)..
En outre, cela lui permet d'interagir parfaitement avec l'éthanol; raison pour laquelle sa présence n'est pas manquée dans les boissons alcoolisées.
D'autre part, son groupe alcoxy le rend capable d'interagir avec certains composés apolaires, tels que le chloroforme, CH3Cl.
Proprietes physiques et chimiques
Des noms
-L'acétate d'éthyle
-Éthanoate d'éthyle
-Ester éthylacétique
-Acétoxyéthane
Formule moléculaire
C4H8OU ALORSdeux ou CH3COOCdeuxH5
Poids moléculaire
88,106 g / mol.
Description physique
Liquide incolore clair.
Couleur
Liquide incolore.
Odeur
Caractéristique des éthers, semblable à l'odeur de l'ananas.
Goût
Agréable lorsqu'il est dilué, ajoute une saveur fruitée à la bière.
Seuil d'odeur
3,9 ppm. 0,0196 mg / m3 (une faible odeur); 665 mg / m3 (forte odeur).
Odeur détectable à 7 - 50 ppm (moyenne = 8 ppm).
Point d'ébullition
171 ° F à 760 mmHg (77,1 ° C).
Point de fusion
-118,5 ° F (-83,8 ° C).
Solubilité dans l'eau
80 g / L.
Solubilité dans les solvants organiques
Miscible avec l'éthanol et l'éther éthylique. Très soluble dans l'acétone et le benzène. Egalement miscible avec le chloroforme, les huiles fixes et volatiles, ainsi qu'avec les solvants oxygénés et chlorés.
Densité
0,9003 g / cm3.
Densité de vapeur
3,04 (dans l'air: rapport 1).
Stabilité
Il se décompose lentement avec l'humidité; incompatible avec divers plastiques et agents oxydants puissants. Le mélange avec de l'eau peut être explosif.
La pression de vapeur
93,2 mmHg à 25 ºC
Viscosité
0,423 mPoids à 25 ° C.
Chaleur de combustion
2 238,1 kJ / mol.
Chaleur de vaporisation
35,60 kJ / mol à 25 ºC.
Tension superficielle
24 dynes / cm à 20 ° C.
Indice de réfraction
1373 à 20 ºC / J.
Température de stockage
2 à 8 ºC.
pKa
16-18 à 25 ºC.
La synthèse
Réaction de Fisher
L'acétate d'éthyle est synthétisé industriellement par la réaction de Fisher, dans laquelle l'éthanol est estérifié avec de l'acide acétique. La réaction est effectuée à température ambiante.
CH3CHdeuxOH + CH3COOH <=> CH3COOCHdeuxCH3 + HdeuxOU ALORS
La réaction est accélérée par catalyse acide. L'équilibre se déplace vers la droite, c'est-à-dire vers la production d'acétate d'éthyle, par élimination de l'eau; selon la loi de l'action de masse.
Réaction de Tishchenko
L'acétate d'éthyle est également préparé industriellement en utilisant la réaction de Tishchenko, en conjuguant deux équivalents d'acétaldéhyde avec l'utilisation d'un alcoolate comme catalyseur..
2 CH3CHO => CH3COOCHdeuxCH3
Autres méthodes
-L'acétate d'éthyle est synthétisé comme coproduit dans l'oxydation du butane en acide acétique, dans une réaction effectuée à une température de 175 ° C et 50 atm de pression. Il est utilisé comme catalyseur pour les ions cobalt et chrome.
-L'acétate d'éthyle est un sous-produit de l'éthanolyse de l'acétate de polyvinyle en alcool polyvinylique.
-L'acétate d'éthyle est également produit dans l'industrie par déshydrogénation de l'éthanol, catalysant la réaction grâce à l'utilisation de cuivre à haute température, mais inférieure à 250 ºC..
Applications
Solvant
L'acétate d'éthyle est utilisé comme solvant et diluant, utilisé dans le nettoyage des circuits imprimés. Il est utilisé comme solvant dans la fabrication d'extrait de houblon modifié et dans la décaféination du café et des feuilles de thé. Il est utilisé dans les encres utilisées pour marquer les fruits et légumes.
L'acétate d'éthyle est utilisé dans l'industrie textile comme agent de nettoyage. Il est utilisé dans l'étalonnage des thermomètres, utilisés dans la séparation des sucres. Dans l'industrie de la peinture, il est utilisé comme solvant et diluant pour les matériaux utilisés..
Arômes artificiels
Il est utilisé dans la production d'arômes de fruits; par exemple: la banane, la poire, la pêche et l'ananas, ainsi que l'arôme du raisin, etc..
Analytique
Il est utilisé dans la détermination du bismuth, du bore, de l'or, du molybdène et du platine, ainsi que comme solvant pour le thallium. L'acétate d'éthyle a la capacité d'extraire de nombreux composés et éléments présents en solution aqueuse, tels que: le phosphore, le cobalt, le tungstène et l'arsenic.
Synthèses organiques
L'acétate d'éthyle est utilisé dans l'industrie comme réducteur de viscosité pour les résines utilisées dans les formulations de photorésist. Utilisé dans la production d'acétamide, d'acétate d'acétate et de méthylheptanone.
Chromatographie
L'acétate d'éthyle est utilisé dans les laboratoires comme phase mobile de chromatographie sur colonne et comme solvant d'extraction. Comme l'acétate d'éthyle a un point d'ébullition relativement bas, il est facile de s'évaporer, ce qui permet de concentrer les substances dissoutes dans le solvant.
Entomologie
L'acétate d'éthyle est utilisé en entomologie pour étouffer les insectes placés dans un contenant, permettant leur collecte et leur étude. Les vapeurs d'acétate d'éthyle tuent l'insecte sans le détruire et l'empêcher de durcir, facilitant son assemblage pour la collecte..
Des risques
-Le LDcinquante d'acétate d'éthyle chez le rat indique une faible toxicité. Cependant, il peut irriter la peau, les yeux, la peau, le nez et la gorge..
-L'exposition à des niveaux élevés peut provoquer des étourdissements et des évanouissements. De même, une exposition à long terme peut affecter le foie et les reins..
-L'inhalation d'acétate d'éthyle à une concentration de 20 000 à 43 000 ppm peut provoquer un œdème pulmonaire et une hémorragie..
-La limite d'exposition professionnelle a été fixée par l'OSHA à 400 ppm dans l'air, en moyenne sur un quart de travail de 8 heures..
Les références
- Steven A. Hardinger. (2017). Glossaire illustré de chimie organique: acétate d'éthyle (EtOAc). Récupéré de: chem.ucla.edu
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (dixe édition.). Wiley plus.
- Morrison, R. T. et Boyd, R. N. (1990). Chimie organique. (5ta édition). Éditorial Addison-Wesley Iberoamericana.
- Wikipédia. (2019). Acétate d'éthyle. Récupéré de: en.wikipedia.org
- Coton S. (s.f.). Acétate d'éthyle. Récupéré de: chm.bris.ac.uk
- PubChem. (2019). Acétate d'éthyle. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Newseed Chemical. (2018). Applications et utilisations de l'acétate d'éthyle. Récupéré de: foodsweeteners.com
- Département de la santé des services aux personnes âgées du New Jersey. (2002). L'acétate d'éthyle. [PDF]. Récupéré de: nj.gov


Personne n'a encore commenté ce post.