
Structure, propriétés, synthèse et utilisations de l'acétate d'isoamyle
le acétate d'isoamyle est un ester dont la formule moléculaire est CH3COO (CHdeux)deuxCH (CH3)deux. À température ambiante, il se compose d'un liquide huileux, clair, incolore, inflammable et volatil. En fait, c'est un ester trop volatil et parfumé.
Sa principale caractéristique est de dégager une odeur qui contribue à l'arôme de nombreux fruits, en particulier ceux de la banane. De même, ce dernier fruit constitue l'une de ses sources naturelles par excellence..

D'où le nom d'huile de banane qui est donné à une solution d'acétate d'isoamyle, ou à un mélange d'acétate d'isomyle avec de la nitrocellulose. Le composé est largement utilisé comme arôme pour la nourriture, la crème glacée et les bonbons.
De plus, il est utilisé dans la production de parfums avec différentes utilisations. C'est également un solvant utilisé dans l'extraction de métaux et de composés organiques tels que l'acide acétique..
L'acétate d'isoamyle est le résultat de l'estérification de l'alcool isoamylique avec de l'acide acétique. Dans les laboratoires d'enseignement de chimie organique, cette synthèse représente une expérience intéressante pour mettre en œuvre l'estérification, tout en inondant le laboratoire de parfum de banane.
Index des articles
- 1 Structure de l'acétate d'isoamyle
- 1.1 Interactions intermoléculaires
- 1.2 Parfum de banane
- 2 propriétés
- 2.1 Noms chimiques
- 2.2 Formule moléculaire
- 2.3 Poids moléculaire
- 2.4 Description physique
- 2.5 Odeur
- 2.6 Saveur
- 2.7 Point d'ébullition
- 2.8 Point de fusion
- 2.9 Point d'éclair
- 2.10 Solubilité dans l'eau
- 2.11 Solubilité dans les solvants organiques
- 2.12 Densité
- 2.13 Densité de vapeur
- 2.14 Pression de vapeur
- 2.15 Température d'auto-inflammation
- 2.16 Viscosité
- 2.17 Chaleur de combustion
- 2.18 Seuil olfactif
- 2.19 Indice de réfraction
- 2.20 Taux d'évaporation relative
- 2.21 Constante diélectrique
- 2.22 Stockage
- 3 Synthèse
- 4 utilisations
- 4.1 Arôme des aliments et des boissons
- 4.2 Solvant et diluant
- 4.3 Parfums
- 4.4 Autres
- 5 risques
- 6 Références
Structure de l'acétate d'isoamyle
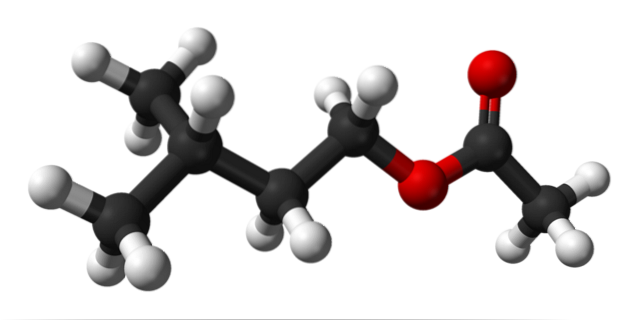
L'image du haut montre la structure moléculaire de l'acétate d'isoamyle à l'aide d'un modèle de sphères et de barres. Les sphères rouges correspondent aux atomes d'oxygène, spécifiquement ceux qui identifient ce composé comme un ester; sa partie éther, R-O-R, et le groupe carbonyle, C = O, ayant alors la formule développée R'COOR.
Sur la gauche, R', nous avons le radical isopentylalkyle, (CH3)deuxCHCHdeuxCHdeux; et à droite, R, au groupe méthyle auquel est dû l '«acétate» du nom de cet ester. C'est un ester relativement petit, capable d'interagir avec les récepteurs chimiques de l'odorat dans notre nez, provoquant des signaux que le cerveau interprète comme un parfum.
Interactions intermoléculaires
La molécule d'acétate d'isoamyle elle-même est flexible; mais, le radical isopentyle ne profite pas aux interactions intermoléculaires car il est ramifié, empêchant stériquement les atomes d'oxygène d'interagir efficacement par les forces dipôle-dipôle.
De plus, ces deux oxygènes ne peuvent pas accepter de liaisons hydrogène; structurellement, la molécule n'a aucun moyen de les donner. Contrairement aux dipôles interrompus, l'acétate d'isoamyle peut interagir de manière intermoléculaire au moyen des forces de dispersion de Londres; qui sont directement proportionnelles à leur masse moléculaire.
Ainsi, c'est la masse moléculaire de l'ester qui est responsable de la formation de ses molécules d'un liquide à haut point d'ébullition (141 ° C). De même, il est responsable de sa fusion solide à une température de -78 ° C.
Parfum de banane
Ses forces intermoléculaires sont si faibles que le liquide est suffisamment volatil pour imprégner son environnement d'odeurs de banane. Fait intéressant, la douce odeur de cet ester peut changer si le nombre de carbones est réduit ou augmenté..
C'est-à-dire que si au lieu d'avoir six carbones aliphatiques il en avait cinq (avec le radical isobutyle), son odeur ressemblerait à celle des framboises; si le radical était secbutyle, l'odeur serait chargée de traces de solvants organiques; et s'il avait plus de six carbones, l'odeur commencerait à devenir savonneuse et métallique.
Propriétés
Noms chimiques
-Acétate d'isoamyle
-Éthanoate d'isopentyle
-Acétate de 3-méthylbutyle
-Acétate d'isopentyle
-Huile de banane ou de plantain.
Formule moléculaire
C7H14OU ALORSdeux ou CH3COO (CHdeux)deuxCH (CH3)deux
Poids moléculaire
130,187 g / mol.
Description physique
C'est un liquide huileux, clair et incolore.
Odeur
À température ambiante, il dégage une odeur de banane intense et agréable.
Goût
Il a une saveur similaire à celle de la poire et de la pomme.
Point d'ébullition
124,5 ºC.
Point de fusion
-78,5 ºC.
point d'allumage
Coupe fermée 92 ° F (33 ° C); tasse ouverte 100 ° F (38 ° C).
Solubilité dans l'eau
2000 mg / L à 25 ºC.
Solubilité dans les solvants organiques
Miscible avec l'alcool, l'éther, l'acétate d'éthyle et l'alcool amylique.
Densité
0,876 g / cm3.
Densité de vapeur
4,49 (par rapport à l'air = 1).
La pression de vapeur
5,6 mmHg à 25 ºC.
La température d'auto-inflammation
680 ºF (360 ºC).
Viscosité
-1,03 cPois à 8,97 ° C
-0,872 cPois à 19,91 ° C.
Chaleur de combustion
8 000 cal / g.
Seuil d'odeur
Air = 0,025 µL / L
Eau = 0,017 mg / L.
Indice de réfraction
1400 à 20 ºC.
Taux d'évaporation relative
0,42 (par rapport à l'acétate de butyle = 1).
Constante dialectrique
4,72 à 20 ºC.
Stockage
L'acétate d'isoamyle est un composé volatil et inflammable. Par conséquent, il doit être conservé au froid dans des récipients complètement hermétiques, à l'écart des substances combustibles..
La synthèse
Il est produit par l'estérification de l'alcool isoamylique avec de l'acide acétique glacial, dans un processus connu sous le nom d'estérification de Fisher. L'acide sulfurique est couramment utilisé comme catalyseur, mais l'acide p-toluènesulfonique catalyse également la réaction:
(CH3)deuxCH-CHdeux-CHdeuxCHdeuxOH + CH3COOH => CH3COOCHdeux-CHdeux-CHdeux-CH (CH3)deux
Applications
Arômes alimentaires et boissons
Il est utilisé pour donner une saveur de poire à l'eau et aux sirops. Il est utilisé en Chine pour préparer des arômes de fruits, tels que la fraise, la mûre, l'ananas, la poire, la pomme, le raisin et la banane. Les doses utilisées sont: 190 mg / kg en confiserie; 120 mg / kg en pâtisserie; 56 mg / kg dans la crème glacée; et 28 mg / kg dans les boissons gazeuses.
Solvant et diluant
C'est un solvant pour:
-Nitrocellulose et celluloïde
-Vernis imperméables
-Gomme ester
-Résine de vinyle
-Résine de coumarone et huile de ricin.
Il est utilisé comme solvant pour la détermination du chrome et comme agent d'extraction du fer, du cobalt et du nickel. Il est également utilisé comme solvant pour les peintures à l'huile et les laques anciennes. De plus, il est utilisé dans la fabrication de vernis à ongles.
Cet ester est utilisé comme diluant dans la production d'acide acétique. Le pétrole est utilisé comme matière première dans un processus d'oxydation qui produit une solution aqueuse d'acide acétique et d'autres composés, tels que l'acide formique et l'acide propionique..
En tant que solvant et support pour d'autres substances, il a été utilisé dans les premiers jours de l'industrie aéronautique pour protéger les tissus des ailes des avions..
Parfums
-Il est utilisé comme assainisseur d'air pour couvrir les mauvaises odeurs.
-Il est utilisé comme parfum dans la laque des chaussures.
-Pour tester l'efficacité des masques à gaz, car l'acétate d'isoamyle a un seuil d'odeur très bas et n'est pas très toxique.
-Il est utilisé dans la production de parfums tels que Chypre; l'osmanthus au doux parfum; la jacinthe; et la forte saveur orientale, utilisée à faibles doses, moins de 1%.
Autres
Il est utilisé dans la production de soie et de perles artificielles, de films photographiques, de vernis imperméables et de bronzants. Il est également utilisé dans l'industrie textile en teinture et en finition. Il est utilisé dans le nettoyage à sec d'articles d'habillement et de meubles en tissu.
De plus, l'acétate d'isoamyle est utilisé dans la production de rayonne, un tissu synthétique; dans l'extraction de la pénicilline et comme substance standard en chromatographie.
Des risques
L'acétate d'isoamyle peut irriter la peau et les yeux par contact physique. L'inhalation peut provoquer une irritation du nez, de la gorge et des poumons. Pendant ce temps, une exposition à des concentrations élevées peut provoquer des maux de tête, de la somnolence, des vertiges, des étourdissements, de la fatigue et des évanouissements..
Un contact prolongé avec la peau peut la rendre sèche et craquelée..
Les références
- Bilbrey Jenna. (30 juillet 2014). Acétate d'isoamyle. Monde de la chimie par la Royal Society of Chemistry. Récupéré de: chemistryworld.com
- Centre national d'information sur la biotechnologie. (2019). Acétate d'isoamyle. Base de données PubChem. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Wikipédia. (2019). Acétate d'isoamyle. Récupéré de: en.wikipedia.org
- Société royale de chimie. (2015). Acétate d'isoamyle. Chemspider. Récupéré de: chemspider.com
- Département de la santé et des services aux personnes âgées du New Jersey. (2005). Acétate d'isoamyle. [PDF]. Récupéré de: nj.gov
- Livre chimique. (2017). Acétate d'isoamyle. Récupéré de: Chemicalbook.com



Personne n'a encore commenté ce post.