
Structure de l'acétate de potassium, propriétés, utilisations, production
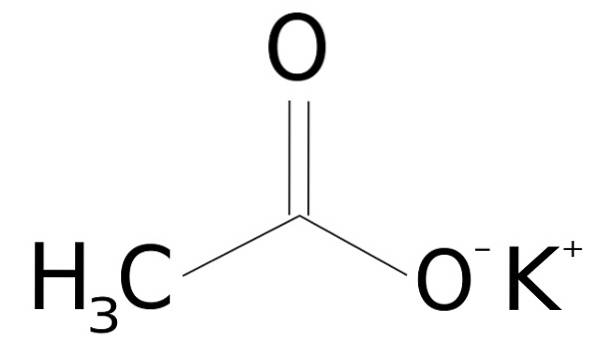
le acétate de potassium est un composé organique formé par un ion potassium K+ et un ion acétate CH3ROUCOULER-. Sa formule chimique est CH3COOK ou KCH3COO, ou aussi CdeuxH3KOdeux. C'est un solide cristallin incolore ou blanc, très soluble dans l'eau..
Il est utilisé pour réguler l'acidité de certains aliments transformés industriellement. En raison de sa grande affinité avec l'eau, il est utilisé dans les laboratoires ou dans certains procédés pour absorber l'eau d'autres composés, comme la déshydratation de l'alcool..

L'acétate de potassium participe à certaines réactions chimiques en tant qu'accélérateur de celles-ci et à la synthèse de composés organiques. Il permet également d'augmenter la formation d'anticorps (substances naturelles qui combattent les infections) dans les méthodes industrielles pour les produire..
Ses propriétés à très basse température en font un bon candidat pour une utilisation dans les mélanges de fonte de glace sur les routes en béton dans les climats très froids. Selon des sources consultées, il est également utilisé dans les équipements de lutte contre l'incendie et dans les assemblages pour observer les cellules dans les microscopes..
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Densité
- 3.5 Solubilité
- 3,6 pH
- 3.7 Autres propriétés
- 3.8 Comportement lors de l'échauffement
- 4 Obtention
- 5 utilisations
- 5.1 Dans diverses applications
- 5.2 Dans l'industrie des polymères
- 5.3 Dans les laboratoires de recherche scientifique et médicale
- 5.4 Dans la production industrielle d'anticorps
- 5.5 Dans les mélanges d'antigel
- 5.6 Comment ça marche comme antigel
- 6 Références
Structure
L'acétate de potassium est composé d'un cation potassium K+ et un anion acétate CH3ROUCOULER-. Ce dernier est la base conjuguée de l'acide acétique CH3COOH. L'ion acétate CH3ROUCOULER- se compose d'un méthyle -CH3 attaché à un carboxylate -COO-.
L'union entre les deux ions est électrostatique ou ionique, c'est-à-dire l'union entre un ion positif et un ion négatif.
Nomenclature
- Acétate de potassium
- Éthanoate de potassium
- Sel de potassium d'acide acétique
- AcOK
- KOAc
Propriétés
État physique
Solide cristallin incolore ou blanc.
Poids moléculaire
98,14 g / mol
Point de fusion
292 ºC
Densité
1,6 g / cm3
Solubilité
Très soluble dans l'eau: 256 g / 100 mL à 20 ° C.
pH
Une solution aqueuse à 5% d'acétate de potassium a un pH de 7,5 à 9,0.
Autres propriétés
Parfois, il a une légère odeur de vinaigre. En solution à 10%, il n'attaque pas l'aluminium à température ambiante mais à 60-70 ° C le métal s'assombrit et subit des piqûres.
À des concentrations de 20% ou plus, une attaque de surface sur l'aluminium se produit à n'importe quelle température.
L'acétate de potassium (AcOK) est très soluble dans l'eau. Il a un hydrate: KCH3COO.1,5HdeuxOu, qui est le solide obtenu en le cristallisant à partir des solutions aqueuses d'AcOK.
Comportement lorsqu'il est chauffé
Si l'acétate de potassium hydraté (AcOK) (KCH3COO.1,5HdeuxO) quand il atteint 40 ° C, il commence à perdre l'eau d'hydratation.
KCH3COO.1,5HdeuxO → KCH3COO + 1,5HdeuxOu ↑
Si l'acétate de potassium anhydre est chauffé (sans eau: KCH3COO), en atteignant 340 ° C, il commence à se décomposer formant du carbonate de potassium KdeuxCO3 selon la réaction suivante:
2 KCH3COO + 4 Odeux → KdeuxCO3 + 3 HdeuxO + 3 COdeux↑
Obtention
Il peut être préparé par action de l'hydroxyde de potassium KOH sur divers composés, tels que l'acide acétique CH3COOH, anhydride acétique (CH3CO)deuxO et acétate d'ammonium CH3COONH4.
KOH + CH3COOH → CH3CUISINER + HdeuxOU ALORS
Il peut également être obtenu par réaction du carbonate de potassium KdeuxCO3 ou bicarbonate de potassium KHCO3 avec de l'acide acétique CH3COOH.
KHCO3 + CH3COOH → CH3CUISINER + HdeuxO + COdeux↑
L'acétate de potassium peut être cristallisé à partir d'une solution aqueuse pour obtenir une grande pureté.
Applications
Dans diverses applications
L'acétate de potassium est utilisé dans l'industrie alimentaire transformée comme régulateur d'acidité. Il est utilisé comme déshydratant dans les méthodes chimiques pour mesurer la perméabilité à la vapeur d'eau de certains tissus..
Il sert d'agent déshydratant pour l'éthanol dans la production de cet alcool à partir de la lignocellulose, un matériau dérivé du bois..
Il est utilisé pour produire des antibiotiques et est largement utilisé dans les équipements de lutte contre l'incendie.
Dans l'industrie des polymères
Il est utilisé pour recycler les polyuréthanes car il sert à catalyser ou accélérer les réactions d'hydrolyse et de glycolyse desdits polymères pour qu'ils deviennent des alcools et des amines..
Il est également utilisé dans la production de résines de silicone organiques.
Dans les laboratoires de recherche scientifique et médicale
L'acétate de potassium de haute pureté est utilisé dans les laboratoires comme réactif en chimie analytique. Effectuer également des recherches médico-scientifiques.
Dans les laboratoires d'histopathologie, il est utilisé pour garantir un milieu de pH neutre dans les configurations de microscope..

Il est utilisé pour la synthèse de composés organiques hétérocycliques, qui sont des composés avec des cycles de tailles différentes..
Certaines microélectrodes utilisées pour étudier les propriétés électriques des cellules sont remplies d'une solution concentrée d'acétate de potassium..
Dans la production industrielle d'anticorps
L'acétate de potassium est utilisé pour la production à grande échelle d'anticorps monoclonaux (qui sont ceux qui proviennent de la même cellule souche) dans des cultures cellulaires. Permet de stimuler la synthèse ou la formation d'anticorps.
Les anticorps sont des substances produites par certaines cellules du sang pour combattre les infections virales ou bactériennes..

Dans les mélanges d'antigel
L'acétate de potassium a été utilisé dans les mélanges d'antigel. antigivrage) afin de les utiliser pour faire fondre la glace sur les routes et les chaussées en ciment et ainsi permettre l'utilisation sûre de ces.

Le choix de l'acétate de potassium (AcOK) pour cette application est dû au fait qu'une solution aqueuse à 50% en poids d'AcOK est eutectique et a un point de fusion de -62 ° C. Cela signifie que même à des températures aussi basses que -62 ° C, la solution reste fondue..
Un eutectique est un mélange homogène de composants qui a le point de fusion le plus bas de tous les mélanges possibles de ceux-ci, y compris celui des composants purs..
Comment ça marche comme antigel
L'acétate de potassium (AcOK) a une très bonne capacité à faire fondre la glace.
À -5 ° C, il est capable de faire fondre 11,5 kg de glace pour chaque kg d'AcOK. Cette propriété diminue à mesure que la température diminue, mais même à -50 ° C, elle a la capacité de faire fondre 1,3 kg de glace pour chaque kg d'AcOH..
A -5 ° C cette capacité est comparable à celle du chlorure de sodium ou du sel de table (NaCl), tandis qu'à partir de -30 ° C elle la dépasse de loin.

Cependant, dans les essais effectués avec AcOK avec d'autres composés, un certain degré de corrosion des surfaces de ciment a été observé, il a donc été envisagé d'ajouter des agents anticorrosifs aux mélanges d'antigel..
D'autre part, le mélange d'acétate de potassium (CH3COOK) avec formiate de potassium (HCOOK) est un excellent antigel et ne nécessite pas d'anticorrosif.
Les références
- Baker, F.J. et coll. (1976). Procédures de coloration. Montants aqueux. In Introduction to Medical Laboratory Technology (Cinquième édition). Récupéré de sciencedirect.com.
- Hassan, A.A. et coll. (2018). Indazoles: synthèse et hétérocyclisation formant des liaisons. In Advances in Heterocyclic Chemistry. Récupéré de sciencedirect.com.
- NOUS. Bibliothèque nationale de médecine. (2019). Acétate de potassium. Récupéré de pubchem.ncbi.nlm.nih.gov.
- Das, A. et Alagirusamy, R. (2010). Transmission d'humidité. Méthode de la tasse inversée déshydratante. Dans Science in Clothing Comfort. Récupéré de sciencedirect.com.
- Vargel, C. (2004). Acides carboxiliques et leurs dérivés. Acétates. Dans la corrosion de l'aluminium. Récupéré de sciencedirect.com.
- Cuevas, J. (2014). Techniques d'enregistrement électrophysiologique. Techniques d'enregistrement intracellulaire. Dans le module de référence en sciences biomédicales. Récupéré de sciencedirect.com.
- Fink, J.K. (2018). Poly (uréthane) s. Recyclage. Solvolyse. In Reactive Polymers: Fundamentals and Applications (troisième édition). Récupéré de sciencedirect.com.
- Fong, W. et coll. (1997). Optimisation de la production d'anticorps monoclonaux: effets combinés de l'acétate de potassium et de la perfusion dans un bioréacteur à cuve agitée. Cytotechnology 24: 47-54. Récupéré de link.springer.com.
- Danilov, V.P. et coll. (2012). Réactifs anti-givrage à basse température dans des systèmes de sel aqueux contenant des acétates et des formiates. Fondements théoriques du génie chimique, 2012, vol 46, n ° 5, pp. 528-535. Récupéré de link.springer.com.
- Fakeev, A.A. et coll. (2012). Recherche et développement d'une méthode pour l'acétate de potassium de haute pureté. Journal of Applied Chemistry, 2012, vol. 85, n ° 12, p. 1807-1813. Récupéré de link.springer.com.


Personne n'a encore commenté ce post.