
Caractéristiques, morphologie, symptômes de l'Acinetobacter baumannii
Acinetobacter baumannii C'est une bactérie à Gram négatif, appartenant à l'ordre des Pseudomonas. Tout au long de son histoire taxonomique, il a été localisé dans les genres Micrococcus, Moraxella, Alcaligenes, Mirococcuscalco-aceticus, Herellea Oui Achromobacter, jusqu'à ce qu'il soit placé dans son genre actuel en 1968.
À. baumannii c'est une bactérie pathogène, considérée comme l'espèce la plus fréquemment impliquée dans les infections de son genre. Il a été identifié comme étant impliqué dans divers types d'infections telles que la septicémie, la pneumonie et la méningite.
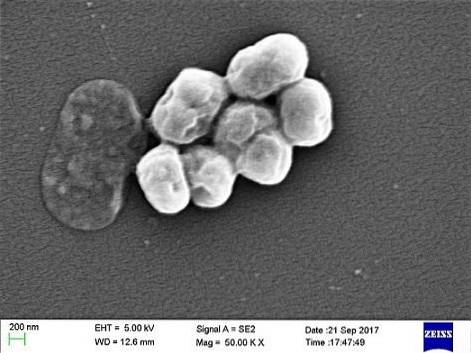
C'est un parasite opportuniste qui a une incidence significative dans les maladies hospitalières ou nosocomiales. La transmission par ventilation mécanique a été identifiée comme une cause importante de contagion, en particulier dans les unités de soins intensifs.
Bien qu'il soit considéré comme un agent pathogène de bas grade, il a la capacité d'augmenter sa virulence dans les souches impliquées dans des infections fréquentes. Il a une grande capacité à développer une résistance et une multi-résistance aux antibiotiques.
Dans les hôpitaux, il se transmet principalement par le contact du personnel, par l'utilisation de matériel hospitalier contaminé et également par l'air sur de courtes distances.
L'Organisation mondiale de la santé comprend A. baumannii sur une liste d'agents pathogènes résistants pour lesquels de nouveaux antibiotiques sont nécessaires de toute urgence, en lui attribuant la catégorie 1, avec une priorité critique.
Index des articles
- 1 Caractéristiques d'Acinetobacter baumannii
- 2 Morphologie
- 3 Métabolisme
- 4 Résistance aux antibiotiques
- 5 pathologies
- 6 Symptômes
- 7 Traitement
- 8 Références
Caractéristiques de Acinetobacter baumannii
Toutes les espèces du genre Acinetobacter ont une large distribution dans différentes niches naturelles. A. baumannii il peut habiter naturellement la peau des personnes en bonne santé, étant capable de coloniser les surfaces muqueuses, ce qui constitue un réservoir épidémiologique important. Cependant, l'habitat de A. baumannii est presque exclusif aux milieux hospitaliers.
Ces bactéries sont dépourvues de flagelles ou de structures utilisées pour la locomotion. Cependant, ils réalisent un mouvement à travers des structures qui leur permettent de s'étendre et de se rétracter, et à travers des mécanismes chimiques tels que l'excrétion d'un film d'un exopolysaccharide de haut poids moléculaire derrière les bactéries..
A. baumannii peut coloniser un grand nombre d'environnements vivants ou inertes et a une grande capacité à survivre sur des surfaces artificielles pendant une période de temps prolongée.
Cette capacité est peut-être due à leur capacité à résister à la déshydratation, à utiliser diverses sources de carbone par diverses voies métaboliques et à leur capacité à former des biofilms. Pour cette raison, il est courant de le trouver dans le matériel hospitalier, comme les cathéters et les dispositifs de ventilation mécanique..
Morphologie
A. baumannii est un coccobacille, de forme intermédiaire entre les cocci et les bâtonnets. Ils mesurent 1,5 à 2,5 sur 1 à 1,5 microns lorsque les populations sont dans une phase de croissance logarithmique. Ils sont plus sphériques lorsqu'ils atteignent la phase stationnaire.
Métabolisme
Les bactéries A. baumannii ce n'est pas un fermenteur de glucose; il est aérobie strict, c'est-à-dire qu'il a besoin d'oxygène pour son métabolisme.
Les espèces du genre Acinetobacter ils sont les seuls de la famille des Moraxellaceae à ne pas avoir de cytochrome c oxydases, pour lesquels ils donnent des résultats négatifs aux tests d'oxydase.
A. baumannii pousse à des températures qui varient entre 20 et 44 ° C, soit sa température optimale entre 30 et 35 ° C.
Résistance aux antibiotiques
La génération constante de résistance aux antibiotiques entrave non seulement le traitement et le contrôle des infections causées par A. baumannii, il favorise également la sélection de souches multi-résistantes endémiques et épidémiques.
Certains mécanismes intrinsèques de A. baumannii, qui favorisent la résistance aux antibiotiques:
- La présence de Les β-lactamases confèrent une résistance aux b-lactamines.
- La production d'enzymes spécifiques telles que l'ammoniglucoside-3'-phosphotransférase VI, inactive l'amikacine.
- La présence d'oxacillinase OXA-51 hydrolyse les pénicillines et les carbapénèmes.
- La présence et la surexpression de pompes à reflux, qui sont des pompes qui expulsent les petites molécules hors de la cellule qui parviennent à pénétrer dans le cytoplasme, réduisant ainsi leur sensibilité aux antibiotiques.
Les biofilms générés par A. baumannii modifier le métabolisme des micro-organismes, réduire leur sensibilité aux antibiotiques, en plus de fournir une barrière physique contre les grosses molécules et de prévenir la déshydratation des bactéries.
Les pathologies
A. baumannii colonise un nouvel hôte par contact avec des personnes infectées ou avec du matériel médical contaminé. Tout d'abord, cette bactérie se fixe sur la peau et les surfaces muqueuses. Pour se reproduire, il doit survivre aux antibiotiques et aux inhibiteurs et aux conditions de ces surfaces..
L'augmentation du nombre de bactéries sur les surfaces muqueuses, en particulier dans les conditions d'hospitalisation en contact avec des cathéters intravasculaires ou des sondes endotrachéales, peut augmenter le risque d'infection des voies respiratoires et de la circulation sanguine..
La pneumonie nosocomiale est la plus fréquente des infections causées par A. baumanii. Communément contracté dans les unités de soins intensifs, par des patients recevant une respiration assistée mécaniquement.
A. baumanii elle a également causé des problèmes d'infection majeurs chez le personnel militaire ayant subi des traumatismes d'après-guerre, en particulier en Irak et en Afghanistan. Plus précisément, en raison de l'ostéomyélite et des infections des tissus mous, qui peuvent provoquer une nécrose et une cellulite.
Il existe également des risques de méningite A. baumanii chez les patients en convalescence après une neurochirurgie.
Les personnes sensibles aux infections par A. baumanii inclure ceux qui ont déjà été soumis à l'utilisation d'antibiotiques, à des chirurgies majeures, à des brûlures, à des traumatismes, à une immunosuppression ou à l'utilisation de dispositifs médicaux invasifs, principalement la ventilation mécanique, dans les unités de soins intensifs.
Symptômes
Il n'y a pas de symptomatologie spécifique des infections par A. baumanii. Chacune des différentes infections produites par cette bactérie a ses propres symptômes caractéristiques..
En général, les symptômes d'infections pouvant impliquer A. baumanii ou d'autres bactéries opportunistes telles que Klebsiella pneumoniae Oui Streptococcus pneumoniae, peut inclure de la fièvre, des frissons, des éruptions cutanées, des mictions douloureuses, un besoin urgent d'uriner fréquemment, de la confusion ou des états mentaux altérés, des nausées, des douleurs musculaires, des douleurs thoraciques et de la toux.
Traitement
Antibiotiques pour traiter les infections par A. baumannii ils sont extrêmement limités, en raison de leur grande capacité à acquérir des résistances et des multi-résistances. Pour cette raison, il est important de déterminer la sensibilité de chaque souche à différents antibiotiques pour garantir l'efficacité de chaque traitement..
Compte tenu de la résistance aux carbapénèmes, l'utilisation de polymyxines, en particulier de colistine, a été utilisée, malgré un indice de résistance relativement faible et ses effets secondaires sur les reins..
Cependant, des souches résistantes à la colistine ont déjà été détectées. Comme alternative à la résistance à ces antibiotiques, une thérapie combinée a été utilisée.
Les références
- Bergogne-Bérézin, E. et Towner, K.J. Acinetobacter spp. comme agents pathogènes nosocomiaux: caractéristiques microbiologiques, cliniques et épidémiologiques. Clin Microbiol Rev, 9 (1996), pp. 148-165.
- Fournier, P.E., Richet, H. (2006). L'épidémiologie et le contrôle des Acinetobacter baumanii dans les établissements de soins de santé. Maladies infectieuses cliniques, 42: 692-9.
- Hernández Torres, A., García Vázquez, E., Yagüe, G. &, Gómez Gómez, J. (2010) Acinetobacter baumanii Multirésistant: situation clinique actuelle et nouvelles perspectives Revista Española de Quimioterapia, 23 (1): 12-19.
- Maragakis LL, Perl TM. Acinetobacter baumanii: épidémiologie, résistance aux antimicrobiens et options de traitement. Clin Infec Dis 2008; 46: 1254-63.
- McConnell, M.j., Actis, L. et Pachón, J. (2013) Acinetobacter baumannii: infections humaines, facteurs contribuant à la pathogenèse et modèles animaux. Examens de microbiologie FEMS, 37: 130-155.
- Peleg, A.Y., Seifert, H. et Paterson, D.L. (2008). Acinetobacter baumannii: émergence d'un agent pathogène efficace. Revues de microbiologie clinique, 21 (3): 538-82.
- Vanegas-Múnera, J.M., Roncancio-Villamil, G. et Jiménez-Quiceno, J.N. (2014). Acinetobacter baumannii: importance clinique, mécanismes de résistance et diagnostic. Magazine CES Medicine, 28 (2): 233-246.



Personne n'a encore commenté ce post.