
Structure, fonction, récepteurs, mécanisme d'action de l'adiponectine
La adiponectine c'est l'une des protéines sécrétoires les plus abondantes produites par un type spécial de cellules appelées adipocytes, caractéristiques du tissu adipeux. Il est responsable de l'augmentation de la sensibilité à l'insuline et est impliqué dans l'homéostasie énergétique et l'obésité.
Le gène de l'adiponectine humaine a été cloné à partir du tissu adipeux en 1996, au cours d'expériences menées par Matsuzawa, qui l'a nommé le transcript-1 du gène adipeux le plus abondant (apM1). transcrit du gène adipeux le plus abondant 1).
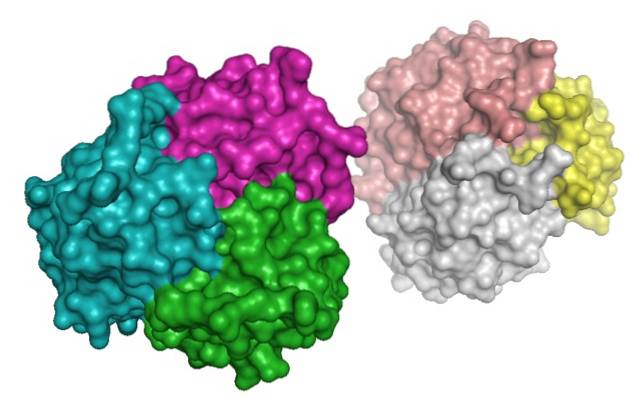
La protéine, en revanche, a été identifiée dans le plasma sanguin la même année par Nakano et al..
Cette hormone contribue à l'intégration des signaux endocriniens et métaboliques liés au contrôle de l'homéostasie énergétique. Son expression est induite lors de la différenciation adipocytaire et circule dans le sérum à des concentrations relativement élevées..
Index des articles
- 1 Structure
- 2 Fonction
- 3 récepteurs
- 3.1 T-cadhérine
- 4 Mécanisme d'action
- 5 Valeurs normales
- 6 Références
Structure
L'adiponectine appartient à la famille des compléments 1q (C1q) et se retrouve dans le plasma sanguin dans une grande variété de complexes multimères (de plusieurs sous-unités): trimères, hexamères et multimères de haut poids moléculaire (de plus de 18 sous-unités).
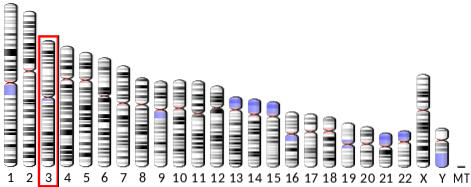
Le gène qui code pour l'adiponectine (ADIPOQ) est situé sur le bras long du chromosome 3 chez l'homme, a 16 kilos de bases et a 3 exons. Son expression donne une protéine hydrosoluble, composée de 247 résidus d'acides aminés et d'un poids moléculaire d'un peu moins de 30 kDa, avec un point isoélectrique de 5,42.
Il est composé de quatre domaines: une séquence signal à l'extrémité N-terminale, une région variable, un domaine collagène (cAd) et un domaine C-terminal globulaire..
Dans la partie amino-terminale, on distingue une séquence de type collagène connue sous le nom de domaine de collagène, qui est une région de grande importance pour la formation de multimères et est hautement conservée entre les espèces.
L'hydroxylation et la glycosylation concomitante des résidus de lysine dans le domaine collagène de cette protéine est ce qui permet la formation de trimères, qui en même temps peuvent s'associer les uns aux autres pour former des hexamères et d'autres complexes de haut poids moléculaire..
Ces complexes ont apparemment une spécificité tissulaire "cible", par exemple les complexes de poids moléculaire élevé sont plus actifs dans le foie, tandis que les trimères et les hexamères agissent sans grande distinction dans une grande variété de tissus..
La région globulaire à l'extrémité C-terminale, appelée domaine globulaire ou gAd, est homologue à des protéines telles que le collagène VIII et le collagène X, ainsi qu'au facteur complémentaire C1q..
Une fonction
D'une manière générale, on pense que l'hormone adiponectine agit de manière pertinente dans la régulation du métabolisme des lipides et des glucides dans divers tissus sensibles à l'insuline..
Cela agit sur différents tissus corporels, car ses récepteurs sont exprimés à plusieurs endroits. Produite exclusivement par les adipocytes, l'adiponectine favorise la biosynthèse des acides gras et l'inhibition de la gluconéogenèse dans le foie, l'un des tissus où se trouve son récepteur AdipoR2..
Dans le muscle squelettique, où se trouvent les récepteurs AdipoR1 et AdipoR2, il favorise l'oxydation des acides gras et l'entrée du glucose dans les cellules musculaires.
L'adiponectine améliore également la résistance à l'insuline chez certains patients, car elle réduit la quantité de graisse intracellulaire en activant l'oxydation des acides gras dans les muscles et le foie..
Certains auteurs suggèrent que cette hormone agit également comme antioxydant, comme agent anti-inflammatoire et comme facteur anti-artériosclérotique.
Récepteurs
Les différents complexes d'adiponectine semblent avoir une certaine préférence par rapport à des tissus spécifiques. Ces interactions spécifiques aux tissus se produisent en réponse à l'expression différentielle de différents types de récepteurs de l'adiponectine..
Les récepteurs de l'adiponectine (AdipoR) sont des récepteurs couplés aux protéines G appartenant à la famille des récepteurs appelés PAQR. Deux types sont connus: AdipoR1 et AdipoR2. Les deux conservent leurs domaines N-terminaux dans l'espace intracellulaire, tandis que leurs domaines C-terminaux sont exposés vers l'espace extracellulaire..
Les récepteurs de type AdipoR1 ont 375 acides aminés et un poids moléculaire de 42 kDa, tandis que les récepteurs de type AdipoR2 ont 311 acides aminés et un poids de 35 kDa. Les deux ont 7 domaines transmembranaires, c'est-à-dire que leur structure traverse la membrane plasmique des cellules où ils se trouvent 7 fois..
Il y a environ 70% d'homologie de séquence entre les deux récepteurs, à l'exception de leurs extrémités N-terminales, qui sont spécifiques de chacun..
AdipoR1 et AdipoR2 sont tous deux exprimés dans tous les tissus, bien que leur abondance varie de l'un à l'autre. AdipoR1 est principalement dans le muscle squelettique et AdipoR2 est dans le muscle squelettique et le foie.
T-cadhérine
Il existe également un récepteur «putatif» pour l'adiponectine appelé T-cadhérine, qui consiste en une seule molécule de cadhérine qui a perdu ses domaines cytosolique et transmembranaire, et est liée à la surface cellulaire par des ancres glycosylphosphatidylinositol (ancres GPI).
Ce «récepteur» de l'adiponectine est exprimé dans tous les tissus, mais il a été rapporté avec une plus grande abondance dans le cœur, dans les artères aortique, carotide et iliaque et dans les artères rénales..
Mécanisme d'action
Bien que les mécanismes de production et de libération d'adiponectine dans la circulation sanguine ne soient pas entièrement compris, on pense que la voie de transduction du signal commence par la liaison de l'adiponectine aux récepteurs membranaires de ses cellules cibles..
Cette hormone induit l'activation de la protéine kinase activée par l'AMP (AMPK), qui se produit via une protéine «adaptateur» qui contient un domaine d'homologie à la pleckstrine (typique des protéines impliquées dans les processus de signalisation cellulaire) et un domaine de liaison à la phosphotyrosine (PTB) , plus un motif de fermeture leucine 1 (APPL).
Le domaine APPL est celui qui se lie à la partie intracellulaire de l'un ou l'autre des deux récepteurs AdipoR. Une petite protéine GTPase connue sous le nom de Rab5 se lie à l'un des sites du domaine de fermeture de la leucine et favorise la translocation membranaire de GLUT4, un transporteur de glucose régulé par l'insuline..
De plus, l'adiponectine agit sur un facteur de transcription nucléaire appelé PPARα, qui est important du point de vue du métabolisme des protéines, des lipides et des glucides, ainsi que de la différenciation et du développement cellulaires..
Valeurs normales
Les valeurs normales rapportées pour l'adiponectine dans le plasma sanguin correspondent à des complexes multimères de cette protéine, dont la plage de concentration est comprise entre 5 et 20 microgrammes par millilitre, bien que des concentrations allant jusqu'à 30 microgrammes par millilitre aient également été documentées..
Compte tenu de ce qui précède, il convient de mentionner que les concentrations plasmatiques d'adiponectine varient considérablement; les femmes, par exemple, ont tendance à avoir des valeurs plus élevées que les hommes.
Les valeurs de cette hormone dépendent fortement de l'état nutritionnel, de la présence ou de l'absence de toute pathologie, etc., mais sont généralement inversement corrélées à l'adiposité et à des conditions telles que les maladies cardiovasculaires, l'hypertension et les syndromes métaboliques..
Il existe des rapports qui garantissent que les concentrations plasmatiques d'adiponectine diminuent chez les patients souffrant d'affections pathologiques telles que la résistance à l'insuline et l'obésité..
Les références
- Chandran, M., Phillips, S. A., Ciaraldi, T., et Henry, R. R. (2003). Adiponectine: plus qu'une simple hormone adipeuse? Soins du diabète, 26 (8), 2442-2450.
- Hirako, S. (2016). Adiponectine. Dans Handbook of Hormones (pp. 308-e34B). Presse académique.
- Kadowaki, T., et Yamauchi, T. (2005). Récepteurs de l'adiponectine et de l'adiponectine. Revues endocriniennes, 26 (3), 439-451.
- Kadowaki, T., Yamauchi, T., Kubota, N., Hara, K., Ueki, K., et Tobe, K. (2006). Récepteurs de l'adiponectine et de l'adiponectine dans la résistance à l'insuline, le diabète et le syndrome métabolique. Le Journal d'investigation clinique, 116 (7), 1784-1792.
- Klein, S. et Romijn, J. A. (2007). Chapitre 35-Obésité. Manuel Williams d'endocrinologie, 11, 1568-1569.
- Steyn, F. J. et Chen, C. (2013). Adiponectine.


Personne n'a encore commenté ce post.