
Logique, préparation et utilisations de la norme de compte de gélose
le nombre d'étalons de gélose Il s'agit d'un milieu de culture solide et non sélectif conçu pour la quantification de la charge microbienne aérobie présente dans des échantillons d'eau potable, d'eaux usées, de boissons laitières, entre autres aliments. Ce milieu est également connu sous le nom de gélose PCA, pour son acronyme en anglais Plate Count Agar. Il a été créé en 1953 par Buchbinder, Baris et Goldstein.
Le milieu gélosé de comptage standard est composé d'extrait de levure, de triptein, de glucose, d'agar et d'eau distillée. Cette formulation contient des éléments nutritionnels de base qui permettent le développement de la charge microbienne aérobie actuelle, non exigeante.
Comme le milieu ne contient pas d'inhibiteurs, les bactéries peuvent se développer sans aucune restriction, ce qui le rend idéal pour le comptage général des colonies. Cependant, la technique de quantification sur plaque ne détectera pas toutes les bactéries présentes, mais seulement celles qui sont capables de croître dans les conditions environnementales auxquelles la gélose de comptage standard ensemencée est soumise..
En ce sens, la technique de quantification sur plaque cherche généralement à déterminer la quantité de bactéries de type aérobie mésophile, c'est-à-dire celles qui se développent à des températures comprises entre 25 et 40 ° C, avec une température de croissance optimale de 37 ° C..
Ce groupe bactérien est très important, car la plupart des bactéries pathogènes pour l'homme s'y trouvent..
Il est à noter qu'il peut parfois être intéressant de quantifier la quantité de bactéries psychrophiles présentes dans les aliments. Ces bactéries sont celles qui se développent à basse température (< 20°C) y son las responsables de que los alimentos se descompongan más rápido, aun estando en nevera.
De même, les bactéries thermophiles, qui se développent dans une plage comprise entre 50 ° C et 80 ° C ou plus, peuvent être importantes dans certains types d'aliments tels que les conserves..
La quantification microbienne est exprimée en unités formant colonie (UFC) par gramme ou millilitre d'échantillon.
Index des articles
- 1 Justification
- 2 Préparation
- 2.1 Pour la technique de la plaque de coulée
- 2.2 Pour semis en surface
- 3 Utilisation
- 3.1 Technique de coulée sur plaque (semis en profondeur)
- 3.2 Technique d'ensemencement de surface
- 4 Contrôle qualité
- 5 Limitations
- 6 Références
Base
Le milieu de comptage standard est conçu pour permettre la croissance réussie de bactéries aérobies non exigeantes, car l'extrait de levure, la triptein et le glucose fournissent les nutriments nécessaires à une bonne croissance microbienne..
D'autre part, le milieu a une couleur claire et un aspect transparent, c'est pourquoi il est idéal pour la visualisation des colonies développées par la méthode de l'ensemencement en profondeur (coulée sur plaque)..
Le comptage des colonies par la méthode de semis de surface à la spatule Drigalski est également possible..
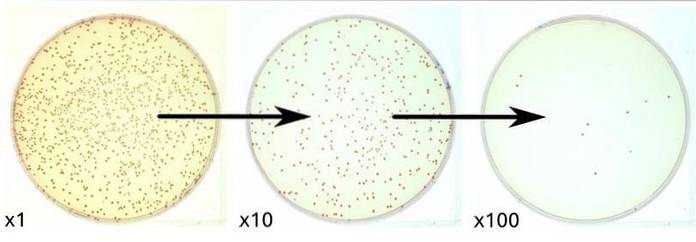
Lorsque la charge microbienne est élevée, des dilutions décimales de l'échantillon à l'étude doivent être effectuées pour pouvoir compter les UFC.
Il est à noter que ce milieu est recommandé par l'American Public Health Association (APHA) pour le dénombrement des mésophiles aérobies..
préparation
Peser 23,5 g de milieu déshydraté et dissoudre dans un litre d'eau distillée. Pour se dissoudre complètement, le mélange doit être chauffé en remuant fréquemment jusqu'à ébullition. Les étapes suivantes dépendent de la technique d'ensemencement à utiliser.
Pour la technique de la plaque de coulée
Distribuer en distribuant 12 à 15 ml dans des tubes à essai. Ensuite, stérilisez dans un autoclave à 121 ° C pendant 15 minutes. Laisser se solidifier verticalement en forme de bloc. Conserver au réfrigérateur jusqu'à utilisation.
Faites fondre la fiche lorsque vous allez l'utiliser. Une fois fondu, conservez-le dans un bain-marie à 44-47 ° C pendant la préparation des échantillons..
Pour semis en surface
Stériliser le milieu dans un autoclave à 121 ° C puis répartir 20 ml dans des boîtes de Pétri stériles. Laisser se solidifier, inverser et conserver au réfrigérateur jusqu'à utilisation.
Tempérer les plaques avant utilisation. Le pH du milieu doit être de 7,0 ± 0,2.
Utiliser
La gélose de dénombrement standard est utilisée dans la technique de dénombrement des mésophiles aérobies lors de l'analyse microbiologique de l'eau et des aliments. Le dénombrement des mésophiles aérobies est nécessaire, car il détermine la qualité sanitaire de l'échantillon étudié..
L'application de cette technique (en utilisant ce milieu) permet la visualisation macroscopique des colonies isolées pour leur quantification..
Technique de coulée sur plaque (semis en profondeur)
-Traiter
La technique comprend les éléments suivants:
1) Homogénéiser l'échantillon afin de redistribuer les bactéries présentes.
2) Une suspension initiale est réalisée dans un flacon ou une poche stérile, en respectant le ratio de 10 gr ou 10 ml d'échantillon dans 90 ml de diluant (10-1).
3) A partir de la suspension initiale, les dilutions décimales pertinentes sont effectuées en fonction du type d'échantillon. Ex: (10-deux, dix-3, dix-4). Les dilutions sont effectuées avec de l'eau peptonée ou un tampon phosphate..
Pour ce faire, prélevez 1 ml de la suspension initiale et placez-le dans 9 ml de diluant, continuez les dilutions si nécessaire, en prenant maintenant 1 ml de la dilution 10-deux et ainsi de suite.
4) Prélever 1 ml de chaque dilution et placer dans des boîtes de Pétri stériles vides.
5) Ajouter à chaque plaque 12 à 15 ml de gélose standard préalablement fondue et décantée à 44 - 47 ° C.
6) Faites tourner doucement les plaques pour répartir uniformément l'échantillon le long de la gélose et lui permettre de se solidifier..
7) Inverser les plaques et incuber à 37 ° C en aérobiose pendant 24 à 48 heures.
8) A la fin du temps, les plaques sont examinées et les colonies sont comptées dans la dilution qui le permet. Les plaques qui ont entre 30 et 300 UFC sont choisies pour le comptage.
Le comptage peut être fait manuellement ou vous pouvez utiliser l'équipement de comptage de colonies.
Les valeurs autorisées par ml d'échantillon peuvent varier d'un pays à l'autre en fonction de la réglementation qui les régit..
-Calcul de CFU
Le calcul général se fait à l'aide de la formule suivante:

Exprimez les résultats en 1 ou 2 chiffres, en multipliant par la base 10 appropriée. Exemple: si le résultat est 16545, il est arrondi en fonction du troisième chiffre à 17000 et il sera exprimé comme suit: 1,7 x 104. Maintenant, si le résultat était 16 436, arrondissez-le à 16 000 et exprimez 1,6 x 104.
Technique d'ensemencement de surface
-Traiter
-Inoculer avec 0,1 ml de l'échantillon direct s'il est liquide, suspension initiale 10-1 ou 10 dilutions consécutives-deux, dix-3 etc, au centre d'une plaque de gélose de comptage standard.
-Répartissez l'échantillon uniformément avec une spatule Drigalski ou une tige en verre en forme de L. Laisser reposer 10 minutes.
-Inverser les plaques et incuber en aérobie à 37 ° C pendant 24 à 48 heures.
-Procéder au comptage des colonies, choisir les plaques comprises entre 20 et 250 UFC.
-Calcul de CFU
Pour le calcul, le facteur de dilution est appliqué, qui est l'inverse. Le nombre est arrondi à 2 chiffres significatifs (arrondi selon le troisième chiffre) et exprimé en puissance de base 10. Par exemple, si 224 UFC sont comptées dans l'échantillon sans dilution (10-1), 22 x 10 est signalé1 UFC, mais si le chiffre était de 225, il est indiqué 23 x 101 UFC.
Maintenant, si vous comptez 199 CFU dans la dilution 10-3, sera signalé 20 x 104 CFU, mais si 153 CFU sont comptés dans la même dilution, 15 x 10 seront déclarés4 UFC.
Contrôle de qualité
Le milieu de culture de comptage standard peut être évalué à l'aide de souches connues certifiées, telles que: Escherichia coli ATCC 8739, Staphylococcus aureus ATCC 6538, Bacillus subtilis ATCC 6633, Lactobacillus fermentum ATCC 9338, Staphylococcus epidermidis ATCC 12228, Shigella flexneri ATCC 12022.
Si le milieu de culture est dans des conditions optimales, une croissance satisfaisante est attendue dans tous les cas, sauf pour L. fermentum qui peut avoir une performance régulière.
Pour évaluer la stérilité du milieu de culture, une ou deux plaques de chaque lot préparé (sans ensemencement) doivent être incubées à 37 ° C en aérobiose pendant 24 heures. Passé ce délai, aucune croissance ou changement de couleur du support ne doit être observé..
Limites
-Ne faites pas fondre la gélose plus d'une fois.
-Le milieu préparé peut durer jusqu'à 3 mois tant qu'il est conservé au réfrigérateur et à l'abri de la lumière..
-Ce milieu ne convient pas aux microorganismes exigeants ou anaérobies.
Les références
- Administration nationale des médicaments, des aliments et de la technologie médicale (ANMAT). Analyse microbiologique des aliments, méthodologie analytique officielle, micro-organismes indicateurs. 2014 Volume 3. Disponible sur: anmat.gov.ar
- Laboratorios Difco Francisco Soria Melguizo, S.A. Gélose sur plaque. 2009. Disponible sur: http://f-soria.es
- Laboratoires Conda Pronadisa. Gélose à méthode standard (PCA) selon APHA et ISO 4833. Disponible sur: condalab.com
- Laboratoires Britannia. Nombre de plaques d'agar. 2015. Disponible sur: britanialab.com
- Camacho A, Giles M, Ortegón A, Palao M, Serrano B et Velázquez O. 2009. Techniques pour l'analyse microbiologique des aliments. 2e éd. Faculté de chimie, UNAM. Mexique. Disponible sur: depa.fquim.unam



Personne n'a encore commenté ce post.