
Contexte, préparation et utilisations de la LIA Agar (Lysine Iron)
le Gélose LIA (Iron Lysine) est un test biochimique utilisé pour l'identification des bactéries de la famille des Enterobacteriaceae. Ce médium a été créé par Edwards et Fife, basé sur la formule Falkow.
A l'origine, ce test était un bouillon contenant des peptones, un extrait de levure, du glucose, de la L-lysine, du violet de bromocrésol et de l'eau distillée. Edwards et Fife ont ajouté de l'agar-agar, du citrate d'ammonium ferrique et du thiosulfate de sodium..
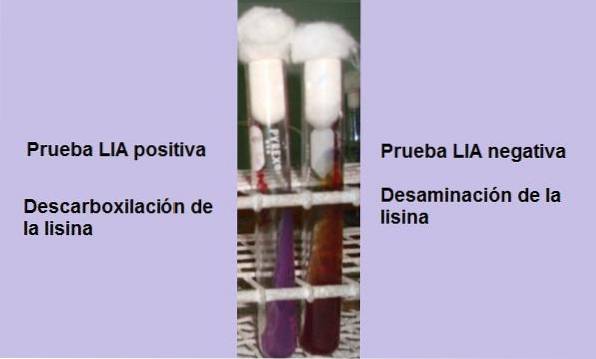
Le test consiste essentiellement à mettre en évidence la présence de l'enzyme lysine décarboxylase, capable de réagir avec le groupement carboxyle de l'acide aminé L-lysine. Une désamination de l'acide aminé peut également se produire en raison de la présence de l'enzyme lysine désaminase..
De plus, la composition du milieu permet de mettre en évidence la capacité de certains genres bactériens à produire du sulfure d'hydrogène. Enfin, il est également possible d'observer la génération ou non de gaz dans le milieu.
Index des articles
- 1 Justification
- 1.1 Peptones et extrait de levure
- 1.2 Glucose
- 1,3 L-lysine
- 1.4 indicateur de pH (bromocrésol violet)
- 1.5 Citrate d'ammonium ferrique et thiosulfate de sodium
- 2 Interprétation du test
- 2.1 Décarboxylation de la lysine
- 2.2 Désamination de la lysine
- 2.3 Production de sulfure d'hydrogène (H2S)
- 3 Registre des résultats
- 4 Préparation
- 5 utilisations
- 6 Références
Base
Peptones et extrait de levure
Comme la plupart des milieux de culture, la gélose à la lysine et au fer contient des composants qui fournissent la source de nutriments nécessaires à la croissance bactérienne. Ces composants sont représentés par des peptones et des extraits de levure.
Glucose
De même, cette gélose contient du glucose en tant que glucide fermentescible. Toutes les bactéries de la famille des entérobactéries sont connues pour fermenter le glucose.
Cette étape est cruciale, car elle sera chargée d'acidifier le milieu, condition essentielle pour que l'enzyme lysine décarboxylase -si présente- agisse sur son substrat..
Dans certains genres bactériens, une production de gaz due à la fermentation du glucose peut être observée.
Le gaz est mis en évidence lorsqu'il y a un déplacement de la gélose dans le tube, laissant un espace vide au fond du tube, ou par fracture du milieu en deux ou plusieurs portions.
L-lysine
Une fois la lysine décarboxylée, une diamine (cadavérine) et du dioxyde de carbone se forment.
La décarboxylation se produit en présence de coenzyme pyridoxal phosphate. Cette réaction est irréversible.
Indicateur de pH (violet de bromocrésol)
Tous les changements de pH qui se produisent dans le milieu en raison des diverses réactions sont détectés par l'indicateur de pH du bromocrésol violet..
En ce sens, lorsqu'il y a acidification, le milieu devient jaune, et lorsqu'il y a alcalinisation, le milieu retrouve sa couleur violette ou violette d'origine..
Lorsque la désamination de la lysine se produit en raison de la présence de l'enzyme lysine désaminase, une couleur rougeâtre se forme à la surface, typique des genres Proteus, Providencia et certaines espèces de Morganella.
Cela est dû au fait que l'acide alpha-céto-carbonique se forme pendant le processus de désamination, qui réagit avec le citrate d'ammonium en présence d'oxygène, provoquant la couleur susmentionnée..
Citrate d'ammonium ferrique et thiosulfate de sodium
D'autre part, les bactéries qui produisent du sulfure d'hydrogène seront mises en évidence par la présence de thiosulfate de sodium (source de soufre) et de citrate d'ammonium ferrique, qui est le révélateur de HdeuxS.
Les bactéries qui possèdent l'enzyme thiosulfate réductase ont la capacité d'agir en réduisant le thiosulfate de sodium présent, formant du sulfite et du sulfure d'hydrogène (HdeuxS).
Ce dernier est un gaz incolore, mais lorsqu'il réagit avec le sel de fer, il forme du sulfure métallique ferreux, qui est un composé insoluble (précipité noir visible).
Cependant, la capacité de formation de HdeuxS avec ce milieu n'est pas très fiable, car certaines bactéries négatives à la lysine décarboxylase capables de produire HdeuxS ne formera pas le précipité noir, car l'acidité du milieu interfère. Par conséquent, il est recommandé de vérifier avec d'autres supports contenant du fer.
Interprétation du test
Décarboxylation de la lysine
Les tubes doivent être lus après les 24 heures d'incubation, sinon il y a un risque d'interprétation erronée de la réaction, rapportant de faux négatifs.
Il faut se rappeler que la première réaction qui se produira sera la fermentation du glucose, donc tous les tubes après 10 à 12 heures deviendront jaunes..
Si à la fin du temps d'incubation (24 heures) un fond jaune avec une surface violette ou violette est observé, la réaction est négative. La couleur violette de la surface correspond à l'alcalinisation du milieu par l'utilisation de peptones.
Une réaction positive est celle où le fond et la surface du tube sont complètement violets, c'est-à-dire qu'il reprend sa couleur d'origine..
Par conséquent, qui détermine la positivité du test est la base ou l'arrière-plan du support. En cas de doute sur la couleur, il peut être comparé à un tube LIA non inoculé.
Désamination de la lysine
Un tube qui montre la désamination de la lysine aura une surface marron rougeâtre et un fond jaune (acide), ou le tube entier aura une couleur marron rougeâtre..
Cette réaction est interprétée comme négative pour la décarboxylation de la lysine, mais positive pour la désamination de la lysine..
Cette réaction est définie et interprétée sur la lunette.
Production de sulfure d'hydrogène (HdeuxS)
Une réaction positive est observée par l'apparition d'un précipité noir dans tout ou partie du milieu. Habituellement entre le bord du biseau et la base.
Si le précipité se produit dans tout le tube, il ne montrera pas les autres réactions qui se produisent au milieu..
Enregistrement des résultats
Lors de l'interprétation du test, les résultats sont enregistrés comme suit:
La lunette est lue en premier, puis le fond ou le bloc, puis la production de HdeuxOui, et enfin la production de gaz.
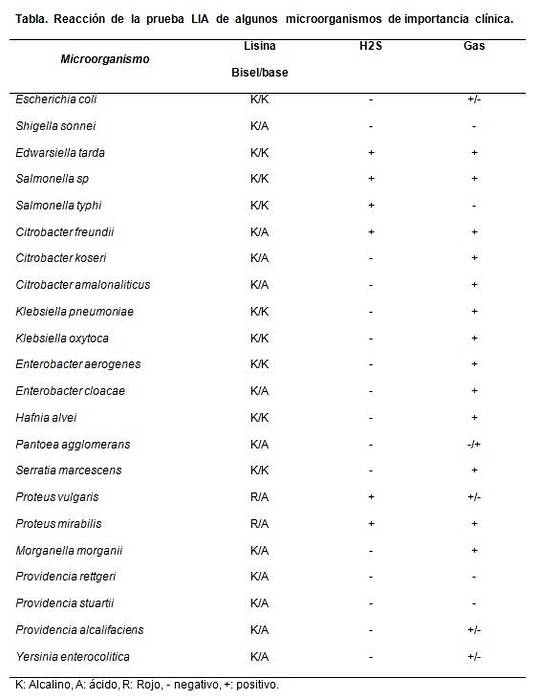
Exemple: K / A + (-). Ça signifie:
- K: lunette alcaline (couleur violette)
- A: fond acide (jaune), c'est-à-dire réaction de décarboxylation négative et désamination négative.
- +: Production de sulfure d'hydrogène
- (-): Sans gaz.
préparation
Peser 35 g du milieu fer-gélose lysine déshydraté et dissoudre dans un litre d'eau distillée..
Chauffer jusqu'à ce que la gélose soit complètement dissoute, pour ce faire, laisser bouillir pendant une minute en remuant fréquemment. Répartir 4 ml de milieu dans des tubes à essai 13/100 avec des bouchons en coton.
Stériliser dans un autoclave à 121 ° C pendant 15 minutes. Retirer de l'autoclave et laisser reposer à un angle, de sorte qu'il y ait une base profonde et un biseau court.
A conserver au réfrigérateur entre 2 et 8 ° C. Laisser réchauffer avant de semer la souche bactérienne.
Le milieu déshydraté est beige et le milieu préparé est violet rougeâtre..
Le pH final du milieu préparé est de 6,7 ± 0,2
Le milieu devient jaune avec un pH égal ou inférieur à 5,2 et est violet à pH 6,5 et plus.
Applications
Ce test, avec d'autres tests biochimiques, est utilisé pour identifier les bacilles de la famille des Enterobacteriaceae..
Le milieu est ensemencé avec une boucle ou une aiguille droite, une ou deux perforations sont effectuées au fond du tube, puis la surface du milieu est entaillée en zigzag..
Incuber pendant 24 heures à 35-37 ° C en aérobiose. Si nécessaire, incuber pendant 24 heures supplémentaires..
Il est principalement utile de différencier les espèces de Citrobacter lactose négatives de Salmonellas sp.
Les références
- Mac Faddin J. (2003). Tests biochimiques pour l'identification des bactéries d'importance clinique. 3e éd. Éditorial Panamericana. Buenos Aires. Argentine.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnostic microbiologique Bailey & Scott. 12 éd. Éditorial Panamericana S.A. Argentine.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnostic microbiologique. 5e éd. Éditorial Panamericana S.A. Argentine.
- Laboratoires Britannia. Gélose à la lysine et au fer. 2015. Disponible sur: britanialab.com
- Laboratoires BD. Gélose BBL Lysine Iron Slants. 2007. Disponible sur: bd.com
- Laboratoires Valtek. Milieu L.I.A. 2009. Disponible sur: andinamedica.com



Personne n'a encore commenté ce post.