
Fondation, préparation et utilisations de l'agar Müeller Hinton
le Gélose Müeller Hinton C'est un milieu nutritif solide et non sélectif, composé d'infusion de viande, de caséine acide peptone, d'amidon, d'agar et d'eau distillée. Ce milieu permet une excellente croissance microbienne de la plupart des bactéries à croissance rapide.
Il a été créé à l'origine par John Howard Müeller et Jane Hinton pour isoler des bactéries exigeantes sur le plan nutritionnel telles que Neisseria gonorrhoeae Oui Neisseria meningitidis. Cependant, en raison de ses caractéristiques, il s'est avéré idéal pour l'étude de la sensibilité aux antibiotiques, fournissant des résultats fiables et reproductibles..
Par conséquent, la gélose Müeller Hinton est le milieu de culture accepté par le Clinical and Laboratory Standards Institute (CLSI) et le Comité européen sur les tests de sensibilité aux antimicrobiens, pour la réalisation du test de sensibilité aux antimicrobiens par la méthode de diffusion sur disque Kirby et Bauer.
Index des articles
- 1 Justification
- 2 Préparation
- 3 utilisations
- 3.1 La technique de l'antibiogramme
- 3.2 Placement stratégique des disques sur la gélose Müeller Hinton
- 4 Causes des résultats erronés
- 5 Limitation
- 6 Contrôle de la qualité
- 7 Références
Base
Étant un milieu nutritif non sélectif, il est excellent pour la croissance de la plupart des bactéries pathogènes..
En revanche, sa composition simple permet aux substances de se diffuser facilement sur lui, étant une caractéristique essentielle pour le test de sensibilité par la méthode de diffusion sur disque..
Une autre de ses caractéristiques est qu'il contient une faible quantité d'inhibiteurs, ce qui permet d'évaluer efficacement les sulfamides, le triméthoprime et les tétracyclines..
Cependant, il faut garder à l'esprit que le support doit remplir certaines conditions pour assurer son bon fonctionnement, notamment:
L'ajustement du pH, de la profondeur de la gélose et de la concentration appropriée de thymine, thymidine, Ca++, Mg++ et Zn++.
Vous devez également savoir que la méthodologie est standardisée et que tous les paramètres doivent donc être respectés, tels que:
La concentration de l'inoculum, la concentration et la conservation des disques antibiotiques, le placement du nombre approprié de disques sur la gélose, la distance entre un disque et l'autre, le placement stratégique de certains antibiotiques, l'atmosphère, la température et le temps d'incubation.
préparation
Peser 37 g de milieu Müeller Hinton déshydraté et dissoudre dans 1 litre d'eau distillée. Chauffer le milieu tout en remuant pour faciliter la dissolution. Faire bouillir pendant 1 minute.
Autoclave pour stériliser à 121 ° C pendant 15 minutes. Lors du retrait de l'autoclave, le ballon doit être placé dans un bain-marie à 50 ° C pour refroidir. Verser 25 à 30 ml dans des boîtes de Pétri stériles de 10 cm de diamètre.
Les plaques doivent avoir une épaisseur moyenne de 4 mm (idéal), avec une plage de 3 à 5 mm.
Si vous souhaitez préparer de la gélose au sang en utilisant de la gélose Müeller Hinton comme base, verser 5% de sang d'agneau stérile et défibriné avant de servir sur les plaques..
Le pH final du milieu doit être compris entre 7,2 et 7,4.
Investissez et conservez au réfrigérateur, jusqu'à utilisation. Laisser la plaque revenir à température ambiante avant utilisation.
La couleur du support préparé est beige clair.
Applications
Utilisé pour effectuer l'antibiogramme ou le test de sensibilité aux antibiotiques pour la plupart des agents pathogènes non exigeants à croissance rapide.
Si la gélose est complétée avec du sang, elle est utilisée pour réaliser l'antibiogramme de microorganismes exigeants tels que: Streptococcus pneumoniae, Haemophilus sp, Neisseria meningitidis, entre autres. Il a également été utilisé pour isoler Legionella pneumophila.
Technique d'antibiogramme
Avant d'effectuer l'antibiogramme, une solution bactérienne équivalente à 1,5 x 10 doit être préparée.8 cellules.
Pour cela, 3 à 4 colonies de la culture pure sont prélevées et mises en suspension dans un bouillon trypticase de soja ou dans un bouillon Müeller Hinton, incubées pendant 2 à 6 heures et la concentration est ajustée avec une solution saline stérile, en la comparant à un standard Mac Farland de 0,5 %.
S'il s'agit de micro-organismes exigeants, les colonies peuvent être suspendues directement jusqu'à la concentration de 0,5% de Mac Farland. Ensuite, la plaque Müeller Hinton est semée avec un écouvillon imprégné de la solution bactérienne préparée..
Pour ce faire, l'écouvillon est immergé dans la solution puis l'excès de liquide est éliminé en appuyant contre les parois du tube. Immédiatement après, l'écouvillon est passé sur toute la surface, ne laissant aucun endroit intact, puis la plaque est légèrement tournée et elle est à nouveau ensemencée. L'opération est répétée 2 fois de plus.
Laisser reposer pendant 10 minutes, puis attacher les disques antibiotiques avec une pince stérile, en laissant un espace de 24 mm entre eux. Après avoir placé chaque disque sur la gélose, appuyez légèrement sur chaque disque avec la pince pour s'assurer qu'ils sont bien adhérés..
Une fois le processus terminé, la plaque est inversée et incubée à 35-37 ° C en aérobiose pendant 16 à 18 heures. S'il s'agit d'un micro-organisme exigeant, il peut justifier une microaérophilie et si l'antibiogramme contient des disques d'oxacilline, il doit être lu après 24 heures..
Une règle est utilisée pour mesurer le diamètre de chaque halo. Les résultats doivent être enregistrés en mm. Par la suite, les valeurs obtenues sont corrélées avec les tables de points de coupure publiées par le manuel CLSI actuel..

Déclarer comme sensible (S), intermédiaire (I) ou résistant (R), selon le cas.
Les antibiotiques sont sélectionnés en fonction du micro-organisme isolé et du type d'infection qui en est à l'origine.
Parfois, le placement stratégique des antibiotiques doit être pris en compte pour montrer les schémas phénotypiques de résistance.
Placement stratégique des disques sur gélose Müeller Hinton
Pour les entérobactéries, le disque d'acide clavulanique doit être placé contre les céphalosporines de 3e et 4e générations. Un élargissement en forme d'œuf indique que la souche est un producteur de bêta-lactamases à spectre étendu (BLSE). Cela signifie que le patient ne doit pas être traité avec des céphalosporines..
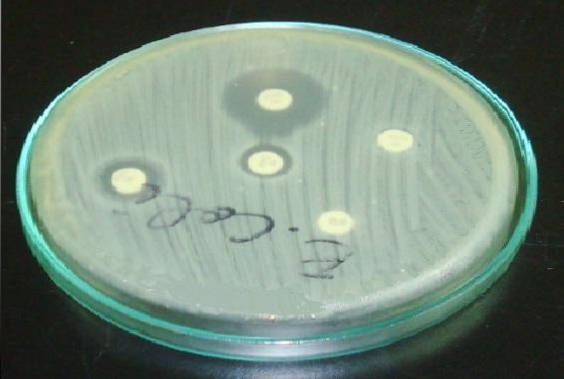
Dans Staphylococcus, il est important de placer le disque d'érythromycine ou d'azithromycine devant le disque de clindamycine (test D).
Un halo résistant à l'érythromycine et un aplatissement du halo de clindamycine indiquent que la souche possède une résistance à la clindamycine inductible par la souche (ICR). Cela signifie qu'un traitement à la clindamycine ne sera pas efficace..
Pour rechercher des souches d'AMP C inductibles chez les entérobactéries et certains bâtonnets Gram négatifs non fermentants, des disques de ceftazidime, de céfoxitine ou de pipéracilline tazobactan sont confrontés à un disque d'imipénème, à une distance de 27 mm.
Un halo aplati dans l'un des disques faisant face à l'imipénème indique la présence d'AMP C inductible.
Pour la recherche du C-AMP constitutif, un disque de cloxacilline de 500 µg est confronté à la ceftazidime (30 µg) et au céfotaxime (30 µg), à une distance de 25 mm. Un halo élargi dans l'une des céphalosporines indique une positivité.
Le disque de cloxacilline peut également être remplacé par un disque de 9 mm de papier filtre Whatman n ° 6 imprégné d'acide phényl borique (400 µg) à une distance de 18 mm. Il est interprété de la même manière que le précédent.
Enfin, pour étudier la production de métallobétalactamases en particulier dans Pseudomonas aeruginosa, Un disque imprégné de 10 µl d'acide éthylènediaminetétraacétique (EDTA 750 µg) et d'acide thioglycolique (SMA 300 µg) est utilisé, qui fait face aux disques d'imipénème et de méropénème, à une distance de 15 mm.
Le test est positif en cas d'élargissement des halos d'imipénème ou de méropénème vers le disque EDTA / SMA. Ce résultat doit être confirmé par le test Hodge modifié..
Cette méthode consiste à ensemencer une souche de Escherichia coli ATCC 25922 sur la plaque Müeller Hinton. Un disque d'imipénème est placé au centre de la plaque puis une strie est faite du disque vers la périphérie avec l'effort de P. aeruginosa méfiant. Jusqu'à 4 souches peuvent être testées par plaque.
Le test sera positif s'il y a une zone de distorsion du halo d'imipénème autour de la vergeture.
Causes des résultats erronés
-Des disques antibiotiques mal conservés peuvent produire une fausse résistance. Par exemple, le disque d'oxacilline est très vulnérable aux changements de température..
-Un pH du milieu inférieur à celui indiqué (acide) produit des halos plus petits dans les aminosides et macrolides (risque de fausse résistance) et des halos plus gros dans la pénicilline, la tétracycline et la novobiocine (risque de fausse sensibilité).
-Si le pH est supérieur à celui indiqué (alcalin), les effets décrits ci-dessus sont inversés.
-Les milieux avec des concentrations élevées de thymine et de thymidine ont une influence en réduisant significativement les halos d'inhibition des sulfamides et du triméthoprime..
-Des concentrations élevées de calcium et de magnésium produisent une fausse résistance des aminosides, de la polymyxine B et des tétracyclines contre les souches de Pseudomonas aeruginosa.
-De faibles concentrations de calcium et de magnésium produisent de fausses sensibilités d'aminosides, de polymyxine B et de tétracyclines contre des souches de Pseudomonas aeruginosa.
-La présence de zinc affecte les résultats des disques de carbapénème (imipénème, méropénème et ertapénème).
-Une épaisseur de support inférieure à 3 mm produira de faux résultats de sensibilité, tandis qu'une épaisseur supérieure à 5 produira une fausse résistance.
-La mobilisation des disques dans l'antibiogramme donnera des halos déformés, car la décharge d'antibiotiques est immédiate.
- Des inoculums très faibles affectent les résultats, car il n'y aura pas de croissance uniforme ou confluente dans la gélose, une condition nécessaire pour pouvoir mesurer les halos d'inhibition, en plus du fait que les halos peuvent donner plus grand que la normale.
-Les inoculums surchargés peuvent donner des halos plus petits que la normale.
-Le non-respect de la distance entre les disques entraîne le chevauchement d'un halo avec un autre et ils ne peuvent pas être lus correctement.
-Incuber avec du COdeux augmente la taille des halos des disques de tétracycline et de méthicilline.
-L'incubation à des températures inférieures à 35 ° C produit des halos plus gros.
-L'ajout de sang diminue la taille du halo de sulfonamide.
Limitation
La sensibilité d'un antibiotique démontrée dans l'antibiogramme contre un microorganisme (in vitro) ne garantit pas que cela fonctionnera in vivo.
Contrôle de qualité
Pour savoir si le milieu contient la quantité adéquate de thymine, une souche doit être cultivée Enterococcus faecalis ATCC 29212 et tester la sensibilité au triméthoprime sulfaméthoxazole (SXT), il doit donner un halo égal ou> 20 mm pour être satisfaisant.
Les références
- «Gélose Müller-Hinton». Wikipedia, l'encyclopédie libre. 16 novembre 2018, 12:23 UTC. 27 janv.2019, 04:22
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnostic microbiologique Bailey & Scott. 12 éd. Éditorial Panamericana S.A. Argentine.
- Cona E. Conditions pour une bonne étude de sensibilité par test de diffusion sur gélose. Rev Chil Infect, 2002; 19 (2): 77-81
- Laboratoire Difco Francisco Soria Melguizo. Gélose Müeller Hinton avec 5% de sang de mouton. 2009. Disponible sur: http://f-soria.es
- Laboratoire de gélose BD Müeller Hinton II. 2017. Disponible sur: .bd.com
- Laboratoires Britannia. Gélose Müeller Hinton. 2015. Disponible sur: britanialab.com
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnostic microbiologique. 5e éd. Éditorial Panamericana S.A. Argentine.
- Martínez-Rojas D. Bétalactamases de type AmpC: généralités et méthodes de détection phénotypique. Rev. Soc. Ven. Microbiol. 2009; 29 (2): 78-83. Disponible sur: scielo.org.
- Perozo A, Castellano M, Ling E, Arraiz N.Détection phénotypique des métallobétalactamases dans des isolats cliniques de Pseudomonas aeruginosa. Kasmera, 2012; 40 (2): 113-121. Disponible sur: scielo.org.



Personne n'a encore commenté ce post.