
Structure de l'alcool secondaire, propriétés, nomenclature, utilisations
UNE alcool secondaire Il a le carbone porteur du groupe hydroxyle (OH), attaché à deux carbones. Alors que, dans l'alcool primaire, le carbone portant le groupe hydroxyle est lié à un atome de carbone, et dans l'alcool tertiaire, il est lié à trois atomes de carbone..
Les alcools sont des acides légèrement plus faibles que l'eau, avec le pKa suivant: eau (15,7); alcools méthylique (15,2), éthylique (16), isopropylique (alcool secondaire 17) et tert-butylique (18). Comme on peut le voir, l'alcool isopropylique est moins acide que les alcools méthyliques et éthyliques..
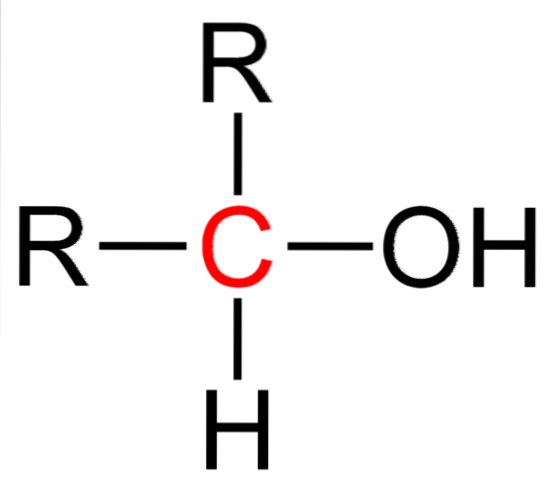
L'image du haut montre la formule développée pour un alcool secondaire. Le carbone en rouge est le support de l'OH et est lié à deux groupes alkyle (ou aryle) R et à un seul atome d'hydrogène.
Tous les alcools ont la formule générique ROH; mais si le carbone porteur est observé en détail, alors les alcools primaires (RCHdeuxOH), secondaire (RdeuxCHOH, ici élevé) et tertiaire (R3COH). Ce fait fait une différence dans ses propriétés physiques et sa réactivité..
Index des articles
- 1 Structure d'un alcool secondaire
- 2 propriétés
- 2.1 Points d'ébullition
- 2.2 Acidité
- 2.3 Réactions
- 3 Nomenclature
- 4 utilisations
- 5 exemples
- 5.1 2-octanol
- 5.2 Estradiol ou 17β-estradiol
- 5.3 20-Hydroxy-leucotriène
- 5.4 2-heptanol
- 6 Références
Structure d'un alcool secondaire
Les structures des alcools dépendent de la nature des groupes R. Cependant, pour les alcools secondaires, un exemple peut être fait, considérant qu'il ne peut y avoir que des structures linéaires avec ou sans ramifications, ou des structures cycliques. Par exemple, vous avez l'image suivante:
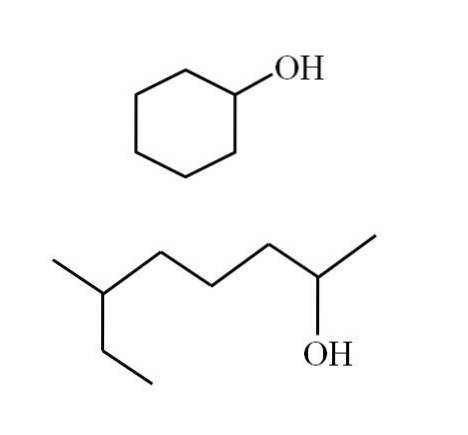
Notez que pour les deux structures il y a quelque chose en commun: l'OH est lié à un "V". Chaque extrémité du V représente un groupe R égal (partie supérieure de l'image, structure cyclique) ou différent (partie inférieure, chaîne ramifiée).
De cette façon, tout alcool secondaire est très facilement identifié, même si sa nomenclature est inconnue du tout..
Propriétés
Points d'ébullition
Les propriétés des alcools secondaires ne diffèrent pas trop physiquement des autres alcools. Ce sont généralement des liquides transparents, et pour être solide à température ambiante, il doit former plusieurs liaisons hydrogène et avoir une masse moléculaire élevée..
Cependant, la même formule développée RdeuxCHOH fait allusion à certaines propriétés uniques en général à ces alcools. Par exemple, le groupe OH est moins exposé et disponible pour les interactions de liaison hydrogène, RdeuxCH-OH-OHCHRdeux.
En effet, les groupes R, adjacents au carbone porteur d'OH, peuvent gêner et entraver la formation de liaisons hydrogène. En conséquence, les alcools secondaires ont des points d'ébullition inférieurs à ceux des alcools primaires (RCHdeuxOH).
Acidité
Selon la définition de Brönsted-Lowry, un acide est un acide qui donne des protons ou des ions hydrogène, H+. Lorsque cela se produit avec un alcool secondaire, vous avez:
RdeuxCHOH + B- => RdeuxCHO- + HB
La base conjuguée RdeuxCHO-, anion alcoxyde, doit stabiliser sa charge négative. Pour l'alcool secondaire, la stabilisation est plus faible puisque les deux groupes R ont une densité électronique, qui repousse dans une certaine mesure la charge négative sur l'atome d'oxygène..
Pendant ce temps, pour l'anion alcoxyde d'un alcool primaire, RCHdeuxOU ALORS-, il y a moins de répulsion électronique car il n'y a qu'un seul groupe R et pas deux. De plus, les atomes d'hydrogène n'exercent pas de répulsion significative, et au contraire, contribuent à stabiliser la charge négative..
Par conséquent, les alcools secondaires sont moins acides que les alcools primaires. Si tel est le cas, alors ils sont plus basiques, et pour exactement les mêmes raisons:
RdeuxCHOH + HdeuxB+ => RdeuxCHOHdeux+ + HB
Or, les groupes R stabilisent la charge positive sur l'oxygène en abandonnant une partie de sa densité électronique..
Réactions
Halogénure d'hydrogène et trihalogénure de phosphore
Un alcool secondaire peut réagir avec un halogénure d'hydrogène. L'équation chimique de la réaction entre l'alcool isopropylique et l'acide bromhydrique, en milieu acide sulfurique, et produisant du bromure d'isopropyle est représentée:
CH3CHOHCH3 + HBr => CH3CHBrCH3 + HdeuxOU ALORS
Et il peut également réagir avec un trihalogène phosphoreux, PX3 (X = Br, I):
CH3-CHOH-CHdeux-CHdeux-CH3 + PBr3 => CH3-CHBr-CHdeux-CHdeux-CH3 + H3PO3
L'équation chimique ci-dessus correspond à la réaction entre le Sec-pentanol et le tribromure de phosphore, à l'origine du bromure de sec-pentyle.
Notez que dans les deux réactions, un halogénure d'alkyle secondaire (RdeuxCHX).
Déshydratation
Dans cette réaction, un H et un OH provenant de carbones voisins sont perdus, formant une double liaison entre ces deux atomes de carbone. Par conséquent, il y a formation d'un alcène. La réaction nécessite un catalyseur acide et l'apport de chaleur.
Alcool => Alcène + HdeuxOU ALORS
Par exemple, nous avons la réaction suivante:
Cyclohexanol => Cyclohexène + HdeuxOU ALORS
Réaction avec les métaux actifs
Les alcools secondaires peuvent réagir avec les métaux:
CH3-CHOH-CH3 + K => CH3CHO-K+CH3 + ½ H+
Ici, l'alcool isopropylique réagit avec le potassium pour former le sel d'isoproxyde des ions potassium et hydrogène..
Estérification
L'alcool secondaire réagit avec un acide carboxylique pour former un ester. Par exemple, l'équation chimique de la réaction de l'alcool sec-butylique avec l'acide acétique pour produire l'acétate de sec-butyle est montrée:
CH3CHOHCHdeuxCH3 + CH3COOH <=> CH3COOCHCH3CHdeuxCH3
Oxydation
Les alcools primaires sont oxydés en aldéhydes, et ceux-ci à leur tour sont oxydés en acides carboxyliques. Mais, les alcools secondaires sont oxydés en acétone. Les réactions sont généralement catalysées par le bichromate de potassium (KdeuxCrO7) et l'acide chromique (HdeuxCrO4).
La réaction globale est:
RdeuxCHOH => RdeuxC = O
Nomenclature
Les alcools secondaires sont nommés indiquant la position du groupe OH dans la chaîne principale (la plus longue). Ce numéro précède le nom, ou il peut venir après le nom de l'alcane respectif pour ladite chaîne.
Par exemple, le CH3CHdeuxCHdeuxCHdeuxCHOHCH3, est le 2-hexanol ou l'hexan-2-ol.
Si la structure est cyclique, il n'est pas nécessaire de placer un numérateur; à moins qu'il n'y ait d'autres substituants. C'est pourquoi l'alcool cyclique de la deuxième image est appelé cyclohexanol (l'anneau est hexagonal).
Et pour l'autre alcool de la même image (le ramifié), son nom est: 6-éthyl-heptan-2-ol.
Applications
-Le sec-butanol est utilisé comme solvant et intermédiaire chimique. Il est présent dans les fluides hydrauliques pour freins, nettoyants industriels, vernis, décapants de peinture, agents de flottation minéraux, essences de fruits et parfums..
-L'alcool isopropanol est utilisé comme solvant industriel et comme anticoagulant. Il est utilisé dans les huiles et les encres à séchage rapide, comme antiseptique et comme substitut de l'éthanol dans les cosmétiques (par exemple: lotions pour la peau, toniques capillaires et alcool à friction).
-L'isopropanol est un ingrédient dans les savons liquides, les nettoyants pour vitres, les arômes synthétiques dans les boissons non alcoolisées et les aliments. De plus, c'est un produit chimique intermédiaire.
-Le cyclohexanol est utilisé comme solvant, dans la finition des tissus, dans le traitement du cuir et comme émulsifiant dans les savons et les détergents synthétiques..
-Le méthylcyclohexanol est un ingrédient des détachants à base de savon et des détergents textiles spéciaux.
Exemples
2-octanol

C'est un alcool gras. C'est un liquide incolore, légèrement soluble dans l'eau, mais soluble dans la plupart des solvants non polaires. Il est utilisé, entre autres utilisations, dans la production d'arômes et de parfums, de peintures et revêtements, d'encres, d'adhésifs, de soins à domicile et de lubrifiants.
Estradiol ou 17β-Estradiol

C'est une hormone sexuelle stéroïde. Il a deux groupes hydroxyle dans sa structure. C'est l'œstrogène prédominant pendant les années de reproduction.
20-Hydroxy-leucotriène
C'est un métabolite qui provient probablement de l'oxydation des lipides leucotriènes. Il est classé comme cystinyl leucotriène. Ces composés sont des médiateurs du processus inflammatoire qui contribue aux caractéristiques physiopathologiques de la rhinite allergique..
2-heptanol
C'est un alcool présent dans les fruits. En outre, on le trouve dans l'huile de gingembre et les fraises. Il est transparent, incolore et insoluble dans l'eau. Il est utilisé comme solvant pour diverses résines et intervient dans la phase de flottation dans le traitement des minéraux.
Les références
- James. (17 septembre 2014). Alcools (1) - Nomenclature et propriétés. Récupéré de: masterorganicchemistry.com
- Encyclopédie de la santé et de la sécurité au travail. (s.f.). Les alcools. [PDF]. Récupéré de: insht.es
- Clark J. (16 juillet 2015). Structure et classification des alcools. Libretexts de chimie. Récupéré de: chem.libretexts.org
- PubChem. (2019). 20-Hydroxy-leucotriène E4. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Morrison, R. T. et Boyd, R, N. (1987). Chimie organique. 5ta Édition. Éditorial Addison-Wesley Interamericana.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (dixe édition.). Wiley plus.
- Wikipédia. (2018). 2-octanol. Récupéré de: en.wikipedia.org



Personne n'a encore commenté ce post.