
Que sont les triades Döbereiner?

le Triades Döbereiner Ce sont des groupes de trois éléments chimiques qui partagent des caractéristiques similaires. Ils font partie des 118 éléments chimiques, étant la diversité des réactions montrées et de leurs composés, leur aspect le plus fascinant.
L'idée de classer les éléments est de traiter adéquatement leurs propriétés chimiques sans qu'il soit nécessaire de développer un ensemble de règles et de théories pour chacun d'eux de manière isolée..
Leur classification périodique a fourni un cadre systématique extrêmement utile pour les corréler selon quelques modèles très simples et logiques..
Les éléments sont systématiquement disposés en lignes et en colonnes avec des numéros atomiques croissants, et l'espace a été réservé aux nouvelles découvertes..
En 1815, une trentaine de pièces seulement étaient connues. Bien qu'il y ait eu beaucoup d'informations disponibles sur ceux-ci et leurs composés, il n'y avait pas d'ordre apparent.
Plusieurs tentatives ont été faites pour trouver l'ordre, cependant, il était difficile d'organiser tout ce qui était connu, de sorte que de nombreux scientifiques ont commencé à rechercher un modèle dans ses propriétés qui permettrait de remédier à cette situation..
Découverte des triades Döbereiner
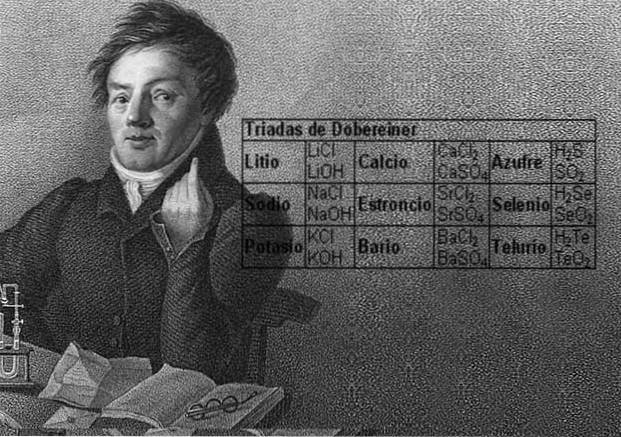
Le scientifique Johann Wolfgang Döbereiner a fait des découvertes importantes sur la régularité numérique entre les poids atomiques des éléments, il a été le premier à remarquer l'existence de plusieurs groupes de trois éléments, qu'il a appelés triades, qui présentaient des similitudes chimiques..
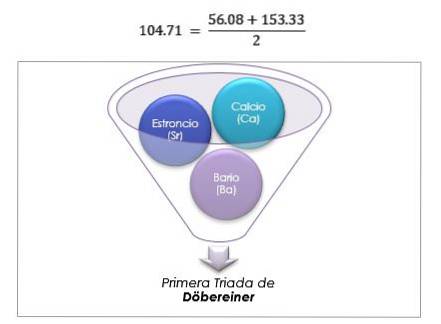
Ces éléments ont révélé une relation numérique importante, puisqu'une fois ordonnés en fonction de leur poids équivalent, ou poids atomique, le poids de l'élément central s'est avéré être la moyenne approximative des deux éléments restants de la triade..
En 1817, Döbereiner a découvert que si certains éléments étaient combinés avec de l'oxygène dans des composés binaires, une relation numérique pouvait être discernée entre les poids équivalents de ces composés..
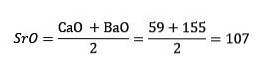
L'observation de Döbereiner a eu peu d'impact sur le monde chimique au début, mais est devenue plus tard très influente. Aujourd'hui, il est considéré comme l'un des pionniers dans le développement du système périodique..
Douze ans plus tard, en 1829, Döbereiner a ajouté trois nouvelles triades, qui sont illustrées ci-dessous:
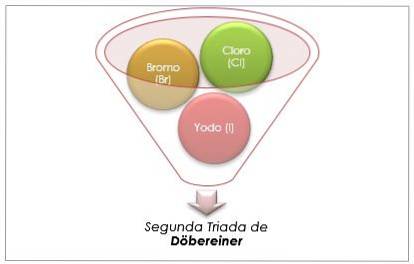
Groupe halogène
Le chlore, le brome et l'iode ont des propriétés chimiques similaires et forment une triade. Ces éléments sont des non-métaux hautement réactifs. S'ils sont classés par ordre de masse relative croissante, ils sont classés par ordre de réactivité décroissante. Le brome a une masse atomique intermédiaire entre le chlore et l'iode.

La masse atomique de l'élément moyen Brome (Br) est égale à la moyenne des masses atomiques de chlore (Cl) et d'iode (I).
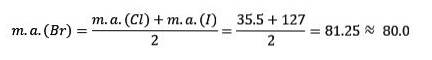
La valeur moyenne obtenue est proche de la masse atomique du Brome (Br).
Similitudes dans les propriétés chimiques:
- Ce sont tous des non-métaux.
- Ils réagissent tous avec l'eau pour former des acides (par exemple, dans: HCl, HBr, HF).
- Ils ont tous une valence de un (par exemple, dans: HCl, HBr, HF).
- Tous réagissent avec les métaux alcalins pour former des sels neutres (par exemple NaCl, NaBr, NaI)
Groupe de métaux alcalins
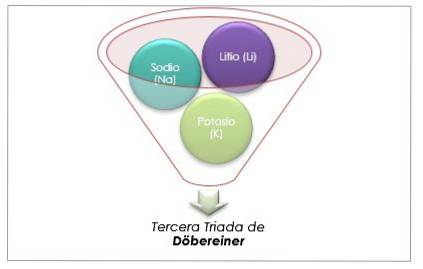
Le lithium, le sodium et le potassium ont des propriétés chimiques similaires et forment une triade. Ces éléments sont des métaux doux et légers mais très réactifs..
S'ils sont classés par ordre croissant de masse atomique relative, ils le sont également par ordre de réactivité croissante. Le sodium a la masse atomique intermédiaire entre le lithium et le potassium.

La masse atomique de l'élément central Sodium (Na) est égale à la moyenne de la masse atomique de Lithium (Li) et Potassium (K).
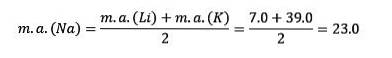
Similitudes dans les propriétés chimiques:
- Ce sont tous des métaux.
- Ils réagissent tous avec l'eau pour former des solutions alcalines et de l'hydrogène gazeux..
- Ils ont tous une valence de un (par exemple, dans: LiCl, NaCl, KCl).
- Ses carbonates résistent à la décomposition thermique.
Groupe de chalcogènes ou d'amphigènes
Le soufre, le sélénium et le tellure ont des propriétés chimiques similaires et forment une triade. Le sélénium a la masse atomique intermédiaire entre le soufre et le tellure.

La masse atomique de l'élément médian Sélénium (Se) est égale aux masses atomiques moyennes de Soufre (S) et Tellure (Te).
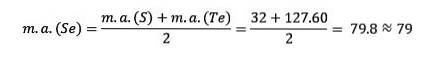
Encore une fois la valeur moyenne obtenue est proche de la masse atomique du sélénium (Se).
Similitudes dans les propriétés chimiques:
- Les combinaisons d'hydrogène de ces éléments produisent des gaz toxiques.
- Chacun de ces éléments a 6 électrons de valence.
- Les qualités métalliques augmentent à mesure que le numéro atomique augmente.

Döbereiner a également noté que les triades doivent révéler des relations chimiques entre les éléments ainsi que des relations numériques pour être valides..
En revanche, il a refusé de regrouper le fluor avec le chlore, le brome et l'iode, comme il aurait pu le faire pour des raisons chimiques, car il n'a pas trouvé de relation triadique entre les poids atomiques du fluor et celui de ces autres halogènes..
Il était également réticent à envisager l'apparition de triades entre des éléments dissemblables, tels que l'azote, le carbone et l'oxygène, malgré le fait qu'ils présentaient une relation numérique triadique significative..
Le travail de Dobereiner s'est concentré sur les relations entre les éléments d'une triade, mais n'a donné aucun indice sur la relation entre les triades..
Qu'il suffise de dire que les recherches de Döbereiner ont établi la notion de triades comme un concept puissant, que plusieurs autres chimistes prendraient bientôt en considération..
En fait, les triades Döbereiner représentaient la première étape pour regrouper les éléments en colonnes verticales dans le tableau périodique et ainsi établir un système qui explique les propriétés chimiques et révèle les relations physiques des éléments..
Extension des triades
D'autres chimistes ont étendu les triades Döbereiner pour inclure plus que les trois éléments d'origine. Par exemple, du fluor a été ajouté au sommet de la triade contenant du chlore, du brome et de l'iode..
D'autres «triades» ont été produites, telles qu'une contenant de l'oxygène, du soufre, du sélénium et du tellure. Mais il n'y avait pas de système qui les corrélait dans leur ensemble.
L'un des principaux inconvénients était que de nombreuses masses atomiques relatives étaient encore erronées pour l'époque..
Les références
- Clugston, M. et Flemming, R. (2000). Chimie avancée. New York, Presse universitaire d'Oxford.
- Johann Wolfgang Döbereiner. Récupéré de: britannica.com.
- Sauders, N. (2010). Percées en science et technologie: qui a inventé le tableau périodique?. Minnesotta, Arcturus Publishing Limited.
- Scerri, E. (2007) Le tableau périodique: son histoire et sa signification. New York, Presse universitaire d'Oxford.
- Shyamal, A. (2008). Chimie des sciences vivantes 10. New Delhi, Ratna Sagar P. Ltd.
- Qu'est-ce que le groupe 16 du tableau périodique? Comment ces éléments sont-ils utilisés? Récupéré de: quora.com.


Personne n'a encore commenté ce post.