
Structure, propriétés, utilisations, risques, explosion du trinitrotoluène (TNT)
le trinitrotoluène est un composé organique composé de carbone, d'oxygène, d'hydrogène et d'azote avec trois groupes nitro -NOdeux. Sa formule chimique est C6Hdeux(CH3)(NE PASdeux)3 ou aussi la formule condensée C7H5N3OU ALORS6.
Son nom complet est le 2,4,6-trinitrotoluène, mais il est communément appelé TNT. C'est un solide cristallin blanc qui peut exploser lorsqu'il est chauffé au-dessus d'une certaine température.

La présence dans le trinitrotoluène des trois groupes nitro -NOdeux favorise le fait qu'il explose avec une certaine facilité. Pour cette raison, il a été largement utilisé dans les engins explosifs, les projectiles, les bombes et les grenades..
Il a également été utilisé pour le dynamitage sous l'eau, dans des puits profonds et pour des explosions industrielles ou non liées à la guerre..
Le TNT est un produit délicat qui peut également exploser sous des coups très forts. Il est également toxique pour les humains, les animaux et les plantes. Les lieux où leurs explosions se sont produites ont été contaminés et des enquêtes sont en cours pour éliminer les restes de ce complexe.
Un moyen efficace et peu coûteux de réduire la concentration de TNT dans l'environnement contaminé consiste à utiliser certains types de bactéries et de champignons..
Index des articles
- 1 Structure chimique
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Point d'ébullition
- 3.5 Point d'éclair
- 3.6 Densité
- 3.7 Solubilité
- 3.8 Propriétés chimiques
- 4 Processus d'explosion de TNT
- 4.1 Réaction d'oxydation du TNT
- 5 Obtention de TNT
- 6 utilisations du TNT
- 6.1 Dans les activités militaires
- 6.2 Dans les applications industrielles
- 7 Risques de TNT
- 8 Pollution de l'environnement avec TNT
- 8.1 Solution à la contamination TNT
- 8.2 Remédiation avec des bactéries et des champignons
- 8.3 Remédiation avec des algues
- 9 Références
Structure chimique
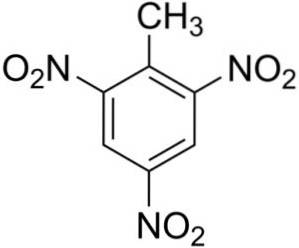
Le 2,4,6-Trinitrotoluène est composé d'une molécule de toluène C6H5-CH3, auquel trois groupes nitro -NO ont été ajoutésdeux.
Les trois groupes nitro -NOdeux ils sont situés symétriquement sur le cycle benzénique du toluène. Ils se trouvent aux positions 2, 4 et 6, où la position 1 correspond au méthyle -CH3.
Nomenclature
- Trinitrotoluène
- 2,4,6-Trinitrotoluène
- TNT
- Trilite
- 2-méthyl-1,3,5-trinitrobenzène
Propriétés
État physique
Solide cristallin incolore à jaune pâle. Cristaux en forme d'aiguille.
Poids moléculaire
227,13 g / mol.
Point de fusion
80,5 ºC.
Point d'ébullition
Ça ne bout pas. Se décompose avec une explosion à 240 ºC.
Point d'inflammation
Il n'est pas possible de le mesurer car il explose.
Densité
1,65 g / cm3
Solubilité
Presque insoluble dans l'eau: 115 mg / L à 23 ° C Très légèrement soluble dans l'éthanol. Très soluble dans l'acétone, la pyridine, le benzène et le toluène.
Propriétés chimiques
Peut se décomposer de manière explosive lorsqu'il est chauffé. En atteignant 240 ° C, il explose. Il peut également exploser lors de coups très violents.
Lorsqu'il est chauffé jusqu'à décomposition, il produit des gaz toxiques d'oxydes d'azote NOX.
Processus d'explosion TNT
L'explosion du TNT entraîne une réaction chimique. Fondamentalement, il s'agit d'un processus de combustion dans lequel l'énergie est libérée très rapidement. De plus, des gaz sont émis qui sont des agents de transfert d'énergie.

Le carburant et l'oxydant doivent être présents pour qu'une réaction de combustion (oxydation) ait lieu.
Dans le cas du TNT, les deux sont dans la même molécule, puisque les atomes de carbone (C) et d'hydrogène (H) sont les carburants et l'oxydant est l'oxygène (O) des groupes nitro -NO.deux. Cela permet à la réaction d'être plus rapide.
Réaction d'oxydation du TNT
Pendant la réaction de combustion du TNT, les atomes se réorganisent et l'oxygène (O) reste plus proche du carbone (C). De plus, l'azote de -NOdeux est réduit pour former de l'azote gazeux Ndeux qui est un composé beaucoup plus stable.
La réaction chimique d'explosion du TNT peut être résumée comme suit:
2 C7H5N3OU ALORS6 → 7 CO ↑ + 7 C + 5 HdeuxO ↑ + 3 Ndeux↑
Le carbone (C) est produit lors de l'explosion, sous la forme d'un nuage noir, et du monoxyde de carbone (CO) est également formé, car il n'y a pas assez d'oxygène dans la molécule pour oxyder complètement tous les atomes de carbone (C) et hydrogène (H) présent.
Obtention de TNT
Le TNT est un composé fabriqué uniquement artificiellement par l'homme.
Il ne se trouve pas naturellement dans l'environnement. Se produit uniquement dans certaines installations militaires.
Il est préparé par nitration du toluène (C6H5-CH3) avec un mélange d'acide nitrique HNO3 et acide sulfurique HdeuxSW4. Vous obtenez d'abord un mélange de ortho- Oui afin de-nitrotoluènes qui, par nitration énergétique ultérieure, forment le trinitrotoluène symétrique.
Utilisations du TNT
Dans les activités militaires
Le TNT est un explosif qui a été utilisé dans des engins de guerre et des explosions militaires.
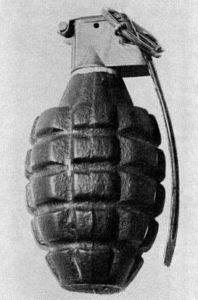
Il est utilisé pour remplir des projectiles, des grenades et des bombes aéroportées, car il est suffisamment insensible à l'impact reçu pour quitter le canon d'une arme, mais il peut exploser lorsqu'il est touché par un mécanisme de détonateur.

Non conçu pour produire une fragmentation importante ou lancer des projectiles.
Dans les applications industrielles
Il a été utilisé pour des explosions d'intérêt industriel, des explosions sous-marines (en raison de son insolubilité dans l'eau) et des explosions de puits profonds. Dans le passé, il était le plus souvent utilisé pour les démolitions. Il est actuellement utilisé avec d'autres composés.

Il a également été un intermédiaire pour les colorants et les produits chimiques photographiques.
Risques de TNT
Peut exploser s'il est exposé à une chaleur intense, un feu ou des chocs très forts.
Il est irritant pour les yeux, la peau et les voies respiratoires. C'est un composé très toxique tant pour les humains que pour les animaux, les plantes et de nombreux micro-organismes..
Les symptômes d'une exposition au TNT comprennent les maux de tête, la faiblesse, l'anémie, l'hépatite toxique, la cyanose, la dermatite, les lésions hépatiques, la conjonctivite, le manque d'appétit, les nausées, les vomissements, la diarrhée, entre autres..
C'est un mutagène, c'est-à-dire qu'il peut changer l'information génétique (ADN) d'un organisme provoquant des changements qui peuvent être liés à l'apparition de maladies héréditaires.
Il a également été classé comme cancérigène ou générateur de cancer.
Pollution de l'environnement avec TNT
Le TNT a été détecté dans les sols et les eaux dans les zones d'opérations de guerre militaire, dans les sites de fabrication de munitions et là où des opérations d'entraînement militaire sont menées..

La contamination par le TNT est dangereuse pour la vie des animaux, des humains et des plantes. Bien que le TNT soit actuellement utilisé en plus petites quantités, c'est l'un des composés nitroaromatiques les plus utilisés dans l'industrie des explosifs..
Pour cette raison, c'est l'un de ceux qui contribuent le plus à la pollution de l'environnement..
Solution à la contamination avec TNT
La nécessité de «nettoyer» les régions contaminées par le TNT a motivé le développement de plusieurs processus d'assainissement. L'assainissement est l'élimination des polluants de l'environnement.
Remédiation avec des bactéries et des champignons
De nombreux micro-organismes sont capables de biorestaurer le TNT, comme les bactéries du genre Pseudomonas, Enterobacter, Mycobactérie Oui Clostridium.
Il a également été constaté qu'il existe certaines bactéries qui ont évolué dans des endroits contaminés par le TNT et qui peuvent survivre et également le dégrader ou le métaboliser en tant que source de nutriments..
La Escherichia coli Par exemple, il a montré une capacité exceptionnelle de biotransformation du TNT, car il dispose de multiples enzymes pour l'attaquer, démontrant en même temps une tolérance élevée envers sa toxicité..
De plus, certaines espèces de champignons peuvent biotransformer le TNT, le transformant en minéraux non nocifs..
Assainissement des algues
D'un autre côté, certains chercheurs ont découvert que l'algue Spiruline platensis a la capacité de s'adsorber à la surface de vos cellules et d'assimiler jusqu'à 87% du TNT présent dans l'eau contaminée par ce composé.
La tolérance de cette algue au TNT et sa capacité à nettoyer l'eau contaminée par elle indiquent le fort potentiel de cette algue en tant que phytorémédiatrice..
Les références
- NOUS. Bibliothèque nationale de médecine. (2019). 2,4,6-Trinitrotoluène. Récupéré de pubchem.ncbi.nlm.nih.gov.
- Murray, S.G. (2000). Explosifs. Mécanisme d'explosion. Dans Encyclopedia of Forensic Sciences 2000, pages 758-764. Récupéré de sciencedirect.com.
- Adamia, G. et coll. (2018). À propos de la possibilité d'application de la spiruline d'algue pour la phytoremédiation de l'eau polluée par le 2,4,6-trinitrotoluène Annales de la science agraire 16 (2018) 348-351. Récupéré de reader.elsevier.com.
- Serrano-González, M.Y. et coll. (2018). Biotransformation et dégradation du 2,4,6-trinitrotoluène par métabolisme microbien et leur interaction. Technologie de la défense 14 (2018) 151-164. Récupéré de pdf.sciencedirectassets.com.
- Iman, M. et coll. (2017). Approche de la biologie des systèmes pour la bioremédiation des nitroaromatiques: analyse basée sur les contraintes de la biotransformation du 2,4,6-trinitrotoluène par Escherichia coli. Molecules 2017, 22, 1242. Récupéré de mdpi.com.
- Windholz, M. et coll. (éditeurs) (1983). L'indice Merck. Une encyclopédie des produits chimiques, des médicaments et des produits biologiques. Dixième édition. Merck & CO., Inc.
- Morrison et R.T. et Boyd, R.N. (2002). Chimie organique. 6e édition. Prentice Hall.

Personne n'a encore commenté ce post.