
Caractéristiques de capillarité et exemple dans l'eau
La capillarité C'est une propriété des liquides qui leur permet de se déplacer à travers des trous tubulaires ou des surfaces poreuses même contre la force de gravité. Pour cela, il doit y avoir un équilibre et une coordination de deux forces liées aux molécules du liquide: la cohésion et l'adhésion; ces deux ont une réflexion physique appelée tension superficielle.
Le liquide doit pouvoir mouiller les parois internes du tube ou les pores du matériau à travers lequel il circule. Cela se produit lorsque la force d'adhésion (paroi du tube capillaire liquide) est supérieure à la force de cohésion intermoléculaire. Par conséquent, les molécules du liquide créent des interactions plus fortes avec les atomes du matériau (verre, papier, etc.) qu'entre eux..
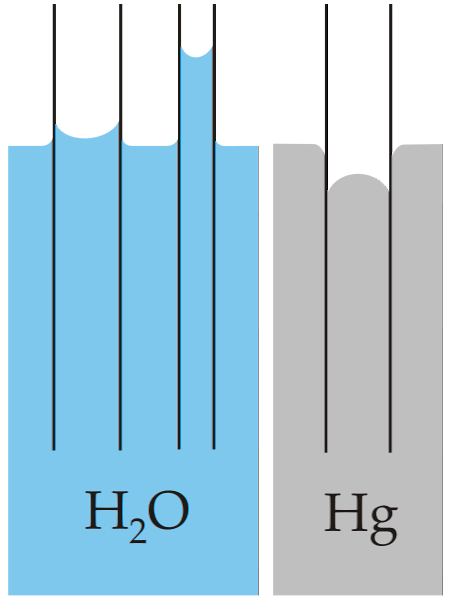
L'exemple classique de capillarité est illustré en comparant cette propriété pour deux liquides très différents: l'eau et le mercure..
Sur l'image ci-dessus, on peut voir que l'eau remonte les parois du tube, ce qui signifie qu'elle a des forces d'adhérence plus importantes; tandis qu'avec le mercure, le contraire se produit, car ses forces de cohésion, de liaison métallique, l'empêchent de mouiller le verre.
Pour cette raison, l'eau forme un ménisque concave et le mercure un ménisque convexe (en forme de dôme). Il faut également noter que plus le rayon du tube ou la section à travers laquelle le liquide circule est petit, plus la hauteur ou la distance parcourue est grande (comparez les hauteurs des colonnes d'eau pour les deux tubes).
Index des articles
- 1 Caractéristiques de la capillarité
- 1.1 -Surface du liquide
- 1.2 -Hauteur
- 1.3 -Tension de surface
- 1.4 - Rayon du capillaire ou du pore à travers lequel le liquide monte
- 1.5 -Angle de contact (θ)
- 2 Capillarité de l'eau
- 2.1 Dans les plantes
- 3 Références
Caractéristiques de la capillarité
-Surface liquide
La surface du liquide, c'est-à-dire de l'eau, dans un capillaire est concave; c'est-à-dire que le ménisque est concave. Cette situation se produit parce que la résultante des forces exercées sur les molécules d'eau près de la paroi du tube est dirigée vers ce.
Dans chaque ménisque, il y a un angle de contact (θ), qui est l'angle formé par la paroi du tube capillaire avec une ligne tangente à la surface du liquide au point de contact.
Forces d'adhésion et de cohésion
Si la force d'adhésion du liquide à la paroi capillaire l'emporte sur la force de cohésion intermoléculaire, alors l'angle est θ < 90º; el líquido moja la pared capilar y el agua asciende por el capilar, observándose el fenómeno conocido como capilaridad.
Lorsqu'une goutte d'eau est déposée sur la surface d'un verre propre, l'eau se répand sur le verre, donc θ = 0 et cos θ = 1.
Si la force de cohésion intermoléculaire prévaut sur la force d'adhésion liquide-paroi capillaire, par exemple dans le mercure, le ménisque sera convexe et l'angle θ aura une valeur> 90º; le mercure ne mouille pas la paroi capillaire et coule donc le long de sa paroi interne.
Lorsqu'une goutte de mercure est placée sur la surface d'un verre propre, la goutte conserve sa forme et l'angle θ = 140º.
-Hauteur
L'eau monte à travers le tube capillaire jusqu'à atteindre une hauteur (h), dans laquelle le poids de la colonne d'eau compense la composante verticale de la force de cohésion intermoléculaire.
Au fur et à mesure que l'eau monte, il arrivera un point où la gravité arrêtera son ascension, même si la tension de surface joue en votre faveur..
Lorsque cela se produit, les molécules ne peuvent pas continuer à «gravir» les parois internes et toutes les forces physiques s'égalisent. D'une part il y a les forces qui favorisent la montée de l'eau, et d'autre part son propre poids la poussant vers le bas.
Loi de Jurin
Cela peut être écrit mathématiquement comme suit:
2 π rϒcosθ = ρgπrdeuxh
Où le côté gauche de l'équation dépend de la tension superficielle, dont la grandeur est également liée à la cohésion ou aux forces intermoléculaires; Cosθ représente l'angle de contact, et r le rayon du trou à travers lequel le liquide monte.
Et sur le côté droit de l'équation, nous avons la hauteur h, la force de gravité g et la densité du liquide; quelle serait l'eau.
Résoudre alors pour h nous avons
h = (2ϒcosθ / ρgr)
Cette formulation est connue sous le nom de loi de Jurin, qui définit la hauteur atteinte par la colonne de liquide, dans le tube capillaire, lorsque le poids de la colonne de liquide est équilibré avec la force d'ascension par capillarité..
-Tension superficielle
L'eau est une molécule dipolaire, en raison de l'électronégativité de l'atome d'oxygène et de sa géométrie moléculaire. Cela provoque une charge négative de la partie de la molécule d'eau où se trouve l'oxygène, tandis que la partie de la molécule d'eau, contenant les 2 atomes d'hydrogène, est chargée positivement..
Les molécules présentes dans le liquide interagissent grâce à cela à travers de multiples liaisons hydrogène, les maintenant ensemble. Cependant, les molécules d'eau qui se trouvent dans l'interface eau: air (surface), sont soumises à une nette attraction par les molécules du sinus du liquide, non compensée par la faible attraction avec les molécules d'air.
Par conséquent, les molécules d'eau à l'interface sont soumises à une force d'attraction qui tend à éliminer les molécules d'eau de l'interface; c'est-à-dire que les liaisons hydrogène formées avec les molécules du bas entraînent celles qui se trouvent à la surface. Ainsi, la tension superficielle cherche à réduire la surface de l'interface eau: air..
Relation avec h
Si nous regardons l'équation de la loi de Jurin, nous trouverons que h est directement proportionnel à ϒ; par conséquent, plus la tension superficielle du liquide est élevée, plus la hauteur qui peut s'élever à travers un capillaire ou un pore d'un matériau est grande.
De cette manière, on peut s'attendre à ce que pour deux liquides, A et B, avec des tensions superficielles différentes, celui avec la plus grande tension superficielle s'élève à une hauteur plus élevée..
On peut conclure sur ce point qu'une tension superficielle élevée est la caractéristique la plus importante qui définit la propriété capillaire d'un liquide..
-Rayon du capillaire ou du pore à travers lequel le liquide monte
L'observation de la loi de Jurin indique que la hauteur qu'un liquide atteint dans un capillaire ou un pore est inversement proportionnelle au rayon du même.
Par conséquent, plus le rayon est petit, plus la hauteur que la colonne de liquide atteint par capillarité est grande. Cela peut être vu directement dans l'image où l'eau est comparée au mercure.
Dans un tube en verre d'un rayon de 0,05 mm de rayon, la colonne d'eau par capillarité atteindra une hauteur de 30 cm. Dans des tubes capillaires d'un rayon de 1 µm avec une pression d'aspiration de 1,5 x 103 hPa (qui est égal à 1,5 atm) correspond à un calcul de la hauteur de la colonne d'eau de 14 à 15 m.
C'est très similaire à ce qui se passe avec ces pailles qui tournent sur elles-mêmes plusieurs fois. En sirotant le liquide, une différence de pression est créée qui fait monter le liquide vers la bouche.
La hauteur maximale de la colonne atteinte par capillarité est théorique, car le rayon des capillaires ne peut être réduit au-delà d'une certaine limite..
Loi de Poiseuille
Ceci établit que l'écoulement d'un liquide réel est donné par l'expression suivante:
Q = (πr4/ 8ηl) ΔP
Où Q est le débit du liquide, η est sa viscosité, l est la longueur du tube et ΔP est la différence de pression.
Au fur et à mesure que le rayon d'un capillaire diminue, la hauteur de la colonne de liquide atteinte par capillarité doit augmenter indéfiniment. Cependant, Poiseuille souligne que lorsque le rayon diminue, l'écoulement du liquide à travers ce capillaire diminue également..
En outre, la viscosité, qui est une mesure de la résistance à l'écoulement d'un liquide réel, diminuerait davantage l'écoulement du liquide..
-Angle de contact (θ)
Plus la valeur de cosθ est élevée, plus la hauteur de la colonne d'eau par capillarité est élevée, comme l'indique la loi de Jurin.
Si θ est petit et s'approche de zéro (0), le cosθ est = 1, donc la valeur h sera maximale. Au contraire, si θ est égal à 90 °, le cosθ = 0 et la valeur de h = 0.
Lorsque la valeur de θ est supérieure à 90 °, ce qui est le cas du ménisque convexe, le liquide ne monte pas par capillarité et sa tendance est à descendre (comme c'est le cas avec le mercure).
Capillarité de l'eau
L'eau a une valeur de tension superficielle de 72,75 N / m, relativement élevée par rapport aux valeurs de tension superficielle des liquides suivants:
-Acétone: 22,75 N / m
-Alcool éthylique: 22,75 N / m
-Hexane: 18,43 N / m
-Méthanol: 22,61 N / m.
L'eau a donc une tension superficielle exceptionnelle, ce qui favorise le développement du phénomène de capillarité si nécessaire à l'absorption d'eau et de nutriments par les plantes..
Dans les plantes

La capillarité est un mécanisme important pour l'ascension de la sève à travers le xylème des plantes, mais elle est insuffisante à elle seule pour amener la sève aux feuilles des arbres..
La transpiration ou l'évaporation est un mécanisme important dans l'ascension de la sève à travers le xylème des plantes. Les feuilles perdent de l'eau par évaporation, générant une diminution de la quantité de molécules d'eau, ce qui provoque une attraction des molécules d'eau présentes dans les capillaires (xylème).
Les molécules d'eau n'agissent pas indépendamment les unes des autres, mais interagissent par les forces de Van der Waals, ce qui les fait monter liées entre elles par les capillaires des plantes vers les feuilles.
En plus de ces mécanismes, il faut noter que les plantes absorbent l'eau du sol par osmose et qu'une pression positive générée dans la racine, entraîne le début de la montée de l'eau à travers les tubes capillaires de la plante..
Les références
- García Franco A. (2010). Phénomènes superficiels. Récupéré de: sc.ehu.es
- Phénomènes de surface: tension superficielle et capillarité. [PDF]. Récupéré de: ugr.es
- Wikipédia. (2018). Capillarité. Récupéré de: es.wikipedia.org
- Risvhan T. (s.f.) Capillarité dans les plantes. Récupéré de: academia.edu
- Helmenstine, Anne Marie, Ph.D. (22 décembre 2018). Action capillaire: définition et exemples. Récupéré de: thinkco.com
- Ellen Ellis M. (2018). Action capillaire de l'eau: définition et exemples. Étude. Récupéré de: study.com
- Personnel de ScienceStruck. (16 juillet 2017). Exemples qui expliquent le concept et la signification de l'action capillaire. Récupéré de: sciencestruck.com

Personne n'a encore commenté ce post.