
Structure des amines, propriétés, types, utilisations, exemples
le amines ce sont des composés organiques dérivés de l'ammoniac. En eux, il existe des liaisons covalentes entre le carbone et l'azote. Naturellement, la molécule d'azote est cinétiquement inerte; mais grâce à la fixation biologique, il se transforme en ammoniac, qui à son tour subit des réactions d'alkylation ultérieures.
Lorsque l'ammoniac est «alkylé», il remplace un, deux ou trois de ses trois hydrogènes par des atomes de carbone. Ces carbones peuvent bien provenir d'un groupe alkyle (R) ou aryle (Ar). Ainsi, il existe des amines aliphatiques (linéaires ou ramifiées), et aromatiques.

La formule générale des amines aliphatiques est indiquée ci-dessus. Cette formule peut être utilisée pour les amines aromatiques, étant donné que R peut également être un groupe aryle Ar. Notez la similitude entre l'amine et l'ammoniac, NH3. Pratiquement, un H a été remplacé par une chaîne latérale R.
Si R est constitué de chaînes aliphatiques, vous avez ce que l'on appelle une alkylamine; tandis que si R est de nature aromatique, une arylamine. Parmi les arylamines, la plus importante de toutes est l'alanine: un groupe amino, -NHdeux, lié au cycle benzénique.
Lorsqu'il y a des groupes oxygénés dans une structure moléculaire, tels que OH et COOH, le composé n'est plus appelé une amine. Dans ce cas, l'amine est considérée comme un substituant: le groupe amino. Par exemple, cela se produit dans les acides aminés, ainsi que dans d'autres biomolécules d'une importance énorme pour la vie..
Parce que l'azote se trouve dans de nombreux composés essentiels à la vie, ceux-ci ont été considérés comme des amines vitales; c'est-à-dire «vitamines». Cependant, de nombreuses vitamines ne sont même pas des amines et, en outre, elles ne sont pas toutes vitales. Cependant, cela ne nie pas sa grande importance dans les organismes vivants..
Les amines sont des bases organiques plus fortes que l'ammoniac lui-même. Ils sont facilement extractibles de la matière végétale et ont généralement de fortes interactions avec la matrice neuronale des organismes; par conséquent, de nombreux médicaments et médicaments sont constitués d'amines avec des structures et des substituants complexes.
Index des articles
- 1 Structure
- 2 Propriétés des amines
- 2.1 Polarité
- 2.2 Caractéristiques physiques
- 2.3 Solubilité dans l'eau
- 2.4 Basicité
- 3 types (primaire, secondaire, tertiaire)
- 4 Entraînement
- 4.1 Alkylation de l'ammoniac
- 4.2 Hydrogénation catalytique
- 5 Nomenclature
- 6 utilisations
- 6.1 Colorants
- 6.2 Médicaments et drogues
- 6.3 Traitement des gaz
- 6.4 Chimie agricole
- 6.5 Fabrication de résines
- 6.6 Nutriments pour les animaux
- 6.7 Industrie du caoutchouc
- 6.8 Solvants
- 7 exemples
- 7.1 Cocaïne
- 7.2 Nicotine
- 7.3 Morphine
- 7.4 Sérotonine
- 8 Références
Structure
Quelle est sa structure? Bien qu'il varie en fonction de la nature de R, l'environnement électronique de l'atome d'azote est le même pour tous: tétraédrique. Mais, comme il y a une paire d'électrons non partagés sur l'atome d'azote (··), la géométrie moléculaire devient pyramidale. C'est le cas de l'ammoniac et des amines.
Les amines peuvent être représentées par un tétraèdre, tout comme les composés carbonés. Ainsi, NH3 et CH4 sont dessinés sous forme de tétraèdres, où la paire (··) est située à l'un des sommets au-dessus de l'azote.
Les deux molécules sont achirales; cependant, ils commencent à présenter de la chiralité lorsque leurs H sont remplacés par R. L'aminé RdeuxNH est achiral si les deux R sont différents. Cependant, il manque de configuration pour différencier un énantiomère d'un autre (comme c'est le cas avec les centres de carbone chiraux).
C'est parce que les énantiomères:
RdeuxN-H | H-NRdeux
ils sont échangés à un rythme tel qu'aucun d'eux ne peut s'isoler; et par conséquent, les structures des amines sont considérées comme achirales même si tous les substituants sur l'atome d'azote sont différents.
Propriétés des amines
Polarité
Les amines sont des composés polaires, puisque le groupe amino NHdeux, en ayant un atome d'azote électronégatif, il contribue au moment dipolaire de la molécule. Notez que l'azote a la capacité de donner des liaisons hydrogène, ce qui fait que les amines ont généralement des points d'ébullition et de fusion élevés..
Cependant, lorsque cette propriété est comparée à celle de composés oxygénés, tels que les alcools et les acides carboxyliques, ils conduisent à des amplitudes plus faibles..
Par exemple, le point d'ébullition de l'éthylamine, CH3CHdeuxNHdeux (16,6 ° C) est inférieure à celle de l'éthanol, CH3CHdeuxOH (78 ° C).
Ainsi, il est montré que les liaisons hydrogène O-H sont plus fortes que celles de N-H, même si une amine peut former plus d'un pont. Cette comparaison n'est valable que si R a le même poids moléculaire pour les deux composés (CH3CHdeux-). Par contre, l'éthane bout à -89 ° C, CH3CH3, être un gaz à température ambiante.
Comme une amine a moins d'hydrogène, elle forme moins de liaisons hydrogène et son point d'ébullition est abaissé. Ceci est vu en comparant le point d'ébullition de la diméthylamine, (CH3)deuxNH (7 ° C), avec celui de l'éthylamine (16,6 ° C).
Caractéristiques physiques
Dans le monde de la chimie, lorsque vous parlez d'une amine, l'acte involontaire de se tenir le nez se produit. En effet, en général, ils ont tendance à avoir des odeurs désagréables, dont certaines ressemblent à celles du poisson pourri..
De plus, les amines liquides ont tendance à avoir des tons jaunâtres, ce qui augmente la méfiance visuelle qu'elles génèrent..
Solubilité dans l'eau
Les amines ont tendance à être insolubles dans l'eau car, bien qu'elles soient capables de former des liaisons hydrogène avec HdeuxOu bien, son composant organique majeur est hydrophobe. Plus les groupes R sont grands ou longs, plus leur solubilité dans l'eau est faible..
Lorsqu'il y a un acide dans le milieu, cependant, la solubilité est augmentée par la formation de ce que l'on appelle des sels d'amine. En eux, l'azote a une charge partielle positive, qui attire électrostatiquement l'anion ou la base conjuguée de l'acide..
Par exemple, dans une solution diluée de HCl, l'amine RNHdeux réagit comme suit:
RNHdeux + HCl => RNH3+Cl- (sel primaire d'amine)
RNHdeux Il était insoluble (ou légèrement soluble) dans l'eau, et en présence de l'acide il forme un sel, dont la solvatation de ses ions favorise sa solubilité.
Pourquoi cela arrive-t-il? La réponse réside dans l'une des principales propriétés des amines: elles sont polaires et basiques. Comme ils sont basiques, ils réagiront avec des acides suffisamment forts pour les protoner, selon la définition de Brönsted-Lowry..
Basicité
Les amines sont des bases organiques plus fortes que l'ammoniac. Plus la densité électronique autour de l'atome d'azote est élevée, plus elle sera basique; c'est-à-dire qu'il déprotonera plus rapidement les acides de l'environnement. Si l'amine est très basique, elle peut même voler le proton des alcools.
Les groupes R contribuent à la densité électronique de l'azote par effet inductif; depuis, il ne faut pas oublier qu'il est l'un des atomes les plus électronégatifs qui existent. Si ces groupes sont très longs ou volumineux, l'effet inductif sera plus important, ce qui augmentera également la région négative autour de la paire d'électrons (··).
Cela amène (··) à accepter l'ion H plus rapidement+. Cependant, si R est très volumineux, la basicité diminue en raison de l'effet stérique. Parce que? Pour la simple raison que le H+ doit traverser une configuration d'atomes avant d'atteindre l'azote.
Une autre manière de raisonner sur la basicité d'une amine consiste à stabiliser son sel d'amine. Or, celui qui diminue par effet inductif peut diminuer la charge positive N+, ce sera une amine plus basique. Les raisons sont les mêmes juste expliquées.
Alkylamines vs arylamines
Les alkylamines sont beaucoup plus basiques que les arylamines. Parce que? Pour le comprendre simplement, la structure de l'aniline est montrée:
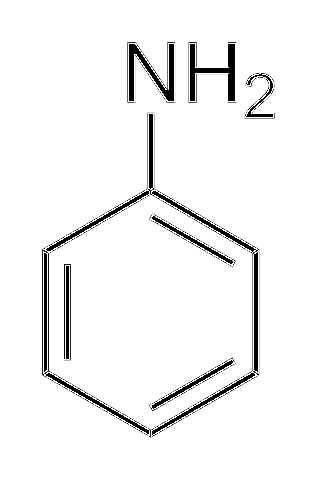
Au-dessus, dans le groupe amino, se trouve la paire d'électrons (··). Cette paire "voyage" à l'intérieur de l'anneau dans les positions ortho et para par rapport à NHdeux. Cela signifie que les deux sommets supérieurs et l'opposé de NHdeux sont chargés négativement, tandis que l'atome d'azote, positivement.
Comme l'azote est chargé positivement, +N, repoussera l'ion H+. Et si cela ne suffit pas, la paire d'électrons est délocalisée dans le cycle aromatique, ce qui la rend moins accessible pour déprotoner les acides..
La basicité de l'aniline peut augmenter si des groupes ou des atomes qui lui confèrent une densité électronique sont liés au cycle, en concurrence avec la paire (··) et en l'obligeant à se situer avec une plus grande probabilité sur l'atome d'azote, prêt à agir comme une base.
Types (primaire, secondaire, tertiaire)

Bien que cela ne soit pas formellement présenté, il a été implicitement fait référence aux amines primaires, secondaires et tertiaires (image du haut, de gauche à droite).
Amines primaires (RNHdeux) sont les monosubstitués; les secondaires (RdeuxNH), sont disubstitués, avec deux groupes R alkyle ou aryle; et les tertiaires (R3N), sont trisubstitués et manque d'hydrogène.
Toutes les amines existantes sont dérivées de ces trois types, leur diversité et leurs interactions avec la matrice biologique et neuronale sont donc énormes.
En général, on peut s'attendre à ce que les amines tertiaires soient les plus basiques; Cependant, une telle déclaration ne peut être faite sans connaître les structures de R.
Formation
Alkylation de l'ammoniac
Au début, il a été mentionné que les amines sont dérivées de l'ammoniac; par conséquent, la manière la plus simple de les former est de les alkyler. Pour ce faire, on fait réagir un excès d'ammoniaque avec un halogénure d'alkyle, suivi de l'ajout d'une base pour neutraliser le sel d'amine:
NH3 + RX => RNH3+X- => RNHdeux
Notez que ces étapes conduisent à une amine primaire. Des amines secondaires et même tertiaires peuvent également être formées, de sorte que le rendement pour un seul produit diminue.
Certaines méthodes de formation, comme la synthèse de Gabriel, permettent d'obtenir des amines primaires afin d'éviter la formation d'autres produits indésirables.
En outre, les cétones et les aldéhydes peuvent être réduits en présence d'ammoniac et d'amines primaires, pour donner naissance à des amines secondaires et tertiaires..
Hydrogénation catalytique
Les composés nitrés peuvent être réduits en présence d'hydrogène et d'un catalyseur en leurs amines correspondantes.
ArNOdeux => ArNHdeux
Nitriles, RC≡N et amides, RCONRdeux, sont également réduits pour donner respectivement des amines primaires et tertiaires.
Nomenclature
Comment les amines sont-elles nommées? La plupart du temps, ils sont nommés en fonction de R, le groupe alkyle ou aryle. Au nom de R, dérivé de son alcane, le mot `` amine '' est ajouté à la fin.
Ainsi, CH3CHdeuxCHdeuxNHdeux est la propylamine. Par contre, il peut être nommé en considérant uniquement l'alcane et non comme un groupe R: propanamine.
La première façon de les nommer est de loin la plus connue et la plus utilisée.
Lorsqu'il y a deux groupes NHdeux, l'alcane est nommé et les positions des groupes amino sont listées. Ainsi, le HdeuxNCHdeuxCHdeuxCHdeuxCHdeuxNHdeux s'appelle: 1,4-butanediamine.
S'il y a des groupes oxygénés, tels que OH, il doit avoir la priorité sur NHdeux, qui se trouve être nommé comme substituant. Par exemple, HOCHdeuxCHdeuxCHdeuxNHdeux Il s'appelle: 3-Aminopropanol.
Et en ce qui concerne les amines secondaires et tertiaires, les lettres N sont utilisées pour indiquer les groupes R. La chaîne la plus longue restera avec le nom du composé. Ainsi le ch3NHCHdeuxCH3 Il s'appelle: N-méthyléthylamine.
Applications
Colorants
Les amines aromatiques primaires peuvent servir de matière de départ pour la synthèse de colorants azoïques. Initialement, les amines réagissent pour former des sels de diazonium, qui forment des composés azo par couplage azo (ou couplage diazo)..
Ceux-ci, en raison de leur coloration intense, sont utilisés dans l'industrie textile comme matière de teinture; par exemple: orange méthylique, brun direct 138, jaune soleil FCF et ponceau.
Drogues et drogues
De nombreux médicaments fonctionnent avec des agonistes et des antagonistes des neurotransmetteurs aminés naturels. Exemples:
-La chlorophéniramine est un antihistaminique utilisé dans le contrôle des processus allergiques dus à l'ingestion de certains aliments, le rhume des foins, les piqûres d'insectes, etc..
-La chlorpromazine est un sédatif et non un somnifère. Soulage l'anxiété et est même utilisé dans le traitement de certains troubles mentaux.
-L'éphédrine et la phényléphédrine sont utilisées comme décongestionnants des voies respiratoires.
-L'amitriptyline et l'imipramine sont des amines tertiaires utilisées dans le traitement de la dépression. En raison de leur structure, ils sont classés comme antidépresseurs tricycliques..
-Les analgésiques opioïdes tels que la morphine, la codeline et l'héroïne sont des amines tertiaires.
Traitement des gaz
Plusieurs amines, dont la diglycolamine (DGA) et la diéthanolamine (DEA), sont utilisées dans l'élimination du dioxyde de carbone (COdeux) et le sulfure d'hydrogène (HdeuxS) présent dans le gaz naturel et les raffineries.
Chimie agricole
Les méthylamines sont des composés intermédiaires dans la synthèse de produits chimiques utilisés en agriculture comme herbicides, fongicides, insecticides et biocides.
Fabrication de résine
Les méthylamines sont utilisées lors de la production de résines échangeuses d'ions, utilisables dans la désionisation de l'eau.
Nutriments animaux
La triméthylamine (TMA) est principalement utilisée dans la production de chlorure de choline, un supplément de vitamine B utilisé dans l'alimentation des poulets, des dindes et des porcs..
Industrie du caoutchouc
L'oléate de diméthylamine (DMA) est un émulsifiant destiné à être utilisé dans la production de caoutchouc synthétique. Le DMA est utilisé directement comme modificateur de polymérisation dans la phase vapeur du butadiène et comme stabilisant pour le latex de caoutchouc naturel à la place de l'ammoniac
Solvants
La diméthylamine (DMA) et la monométhylamine (MMA) sont utilisées pour synthétiser les solvants polaires aprotiques diméthylformamide (DMF), diméthylacétamide (DMAc) et n-méthylpyrrolidone (NMP).
Les applications du DMF comprennent: le revêtement d'uréthane, le solvant de fil acrylique, les solvants de réaction et les solvants d'extraction.
Le DMAc est utilisé dans la fabrication de colorants pour fils et de solvants. Enfin, la NMP est utilisée dans le raffinage des huiles lubrifiantes, du décapant pour peinture et du revêtement d'émail..
Exemples
Cocaïne
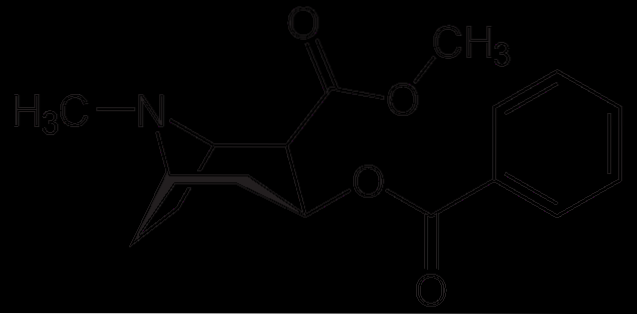
La cocaïne est utilisée comme anesthésique local dans certains types de chirurgie des yeux, des oreilles et de la gorge. Comme on le voit, c'est une amine tertiaire.
Nicotine

La nicotine est le principal agent de la dépendance au tabac et, chimiquement, c'est une amine tertiaire. La nicotine contenue dans la fumée de tabac est rapidement absorbée et hautement toxique.
Morphine
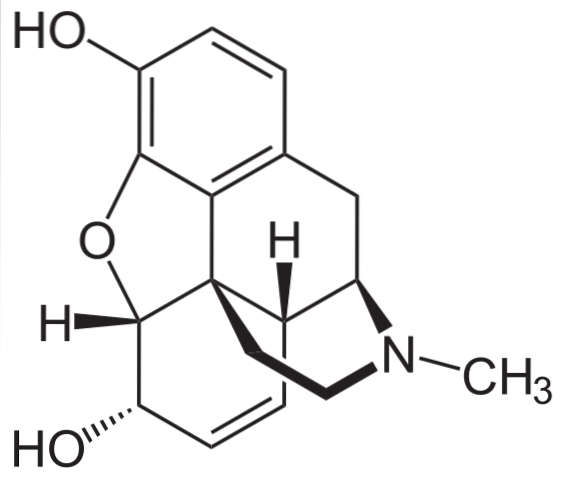
C'est l'un des analgésiques les plus efficaces pour soulager la douleur, en particulier le cancer. C'est, encore une fois, une amine tertiaire.
Sérotonine

La sérotonine est un neurotransmetteur amine. Chez les patients déprimés, la concentration du principal métabolite de la sérotonine est diminuée. Contrairement aux autres amines, celle-ci est primaire.
Les références
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (dixe édition.). Wiley plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Morrison et Boyd. (1987). Chimie organique. (Cinquième édition). Addison-Wesley Iberoamericana.
- La société Chemours. (2018). Méthylamines: utilisations et applications. Récupéré de: chemours.com
- Étude de marché sur la transparence. (s.f.). Amines: faits et utilisations importants. Récupéré de: transparentmarketresearch.com
- Wikipédia. (2019). Amine. Récupéré de: en.wikipedia.org
- Ganong, W. F. (2003). Physiologie médicale. 19e édition. Éditorial Le manuel moderne.



Personne n'a encore commenté ce post.