
Propriétés colligatives (avec formules)
La propriété colligative est toute propriété d'une substance qui dépend ou varie en fonction du nombre de particules qu'elle contient (sous forme de molécules ou d'atomes), sans dépendre de la nature de ces particules.
En d'autres termes, ceux-ci peuvent également être expliqués comme des propriétés de solutions qui dépendent de la relation entre le nombre de particules de soluté et le nombre de particules de solvant. Ce concept a été introduit en 1891 par le chimiste allemand Wilhelm Ostwald, qui a classé les propriétés du soluté en trois catégories.

Ces catégories proclamaient que les propriétés colligatives dépendaient uniquement de la concentration et de la température du soluté et non de la nature de ses particules..
En outre, les propriétés additives telles que la masse dépendaient de la composition du soluté, et les propriétés constitutionnelles dépendaient davantage de la structure moléculaire du soluté..
Index des articles
- 1 Propriétés colligatives
- 1.1 Diminution de la pression de vapeur
- 1.2 Augmentation de la température d'ébullition
- 1.3 Abaisser la température de congélation
- 1.4 Pression osmotique
- 2 Références
Propriétés colligatives
Les propriétés colligatives sont étudiées principalement pour les solutions diluées (en raison de leur comportement presque idéal), et sont les suivantes:
Diminution de la pression de vapeur
On peut dire que la pression de vapeur d'un liquide est la pression d'équilibre des molécules de vapeur avec lesquelles ce liquide est en contact.
De même, la relation de ces pressions est expliquée par la loi de Raoult, qui exprime que la pression partielle d'un composant est égale au produit de la fraction molaire du composant par la pression de vapeur du composant à l'état pur:
PÀ = XÀ . PºÀ
Dans cette expression:
PÀ = Pression de vapeur partielle du composant A dans le mélange.
XÀ = Fraction molaire du composant A.
PºÀ= Pression de vapeur du composant pur A.
Dans le cas de la diminution de la pression de vapeur d'un solvant, cela se produit lorsqu'un soluté non volatil y est ajouté pour former une solution. Comme on le sait et par définition, une substance non volatile n'a pas tendance à s'évaporer.
Pour cette raison, plus ce soluté est ajouté au solvant volatil, plus la pression de vapeur sera basse et moins le solvant peut s'échapper pour devenir un état gazeux..
Ainsi, lorsque le solvant s'évapore naturellement ou de force, une quantité de solvant restera finalement sans s'évaporer avec le soluté non volatil..
Ce phénomène peut être mieux expliqué avec le concept d'entropie: lorsque les molécules font une transition de la phase liquide à la phase gazeuse, l'entropie du système augmente..
Cela signifie que l'entropie de cette phase gazeuse sera toujours supérieure à celle de l'état liquide, car les molécules de gaz occupent un plus grand volume..
Ensuite, si l'entropie de l'état liquide augmente par dilution, même si elle est liée à un soluté, la différence entre les deux systèmes diminue. Pour cette raison, la diminution de l'entropie diminue également la pression de vapeur..
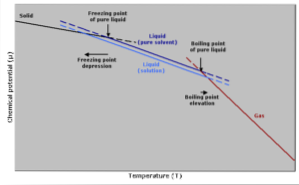
Augmentation de la température d'ébullition
Le point d'ébullition est la température à laquelle il y a équilibre entre les phases liquide et gazeuse. À ce stade, le nombre de molécules de gaz devenant liquides (condensation) est égal au nombre de molécules liquides s'évaporant en gaz..
L'ajout d'un soluté entraîne une dilution de la concentration de molécules liquides, ce qui entraîne une diminution de la vitesse d'évaporation. Cela génère un changement du point d'ébullition, pour compenser le changement de concentration du solvant..
En d'autres termes plus simples, la température d'ébullition d'une solution est supérieure à celle du solvant à l'état pur. Ceci est exprimé par une expression mathématique ci-dessous:
ΔTb = i. Kb . m
Dans cette expression:
ΔTb = Tb (solution) - Tb (solvant) = Variation de la température d'ébullition.
i = facteur de van't Hoff.
Kb = Constante d'ébullition du solvant (0,512 ºC / molale pour l'eau).
m = molalité (mol / kg).
Réduction de la température de congélation
La température de congélation d'un solvant pur diminuera lorsqu'une quantité de soluté est ajoutée, car elle est affectée par le même phénomène que la pression de vapeur diminue..
Cela se produit car, en diminuant la pression de vapeur du solvant en diluant un soluté, une température plus basse sera nécessaire pour le faire geler..
La nature du processus de congélation peut également être prise en compte pour expliquer ce phénomène: pour qu'un liquide gèle, il doit atteindre un état ordonné dans lequel il finit par former des cristaux..
S'il y a des impuretés dans le liquide sous forme de solutés, le liquide sera moins ordonné. Pour cette raison, la solution aura plus de difficultés à geler qu'un solvant sans impuretés..
Cette réduction est exprimée par:
ΔTF = -i. KF . m
Dans l'expression ci-dessus:
ΔTF = TF (solution) - TF (solvant) = variation de température de congélation.
i = facteur de van't Hoff.
KF = Constante de congélation du solvant (1,86 ºC kg / mol pour l'eau).
m = molalité (mol / kg).
Pression osmotique
Le processus connu sous le nom d'osmose est la tendance d'un solvant à passer à travers une membrane semi-perméable d'une solution à une autre (ou d'un solvant pur à une solution).
Cette membrane représente une barrière à travers laquelle certaines substances peuvent passer et d'autres non, comme dans le cas des membranes semi-perméables dans les parois cellulaires des cellules animales et végétales..
La pression osmotique est alors définie comme la pression minimale qui doit être appliquée à une solution pour arrêter le passage de son solvant pur à travers une membrane semi-perméable..
Il est également connu comme la mesure de la tendance d'une solution à recevoir le solvant pur en raison de l'effet de l'osmose. Cette propriété est colligative car elle dépend de la concentration de soluté dans la solution, qui s'exprime sous la forme d'une expression mathématique:
Π. V = n. R. T, ou aussi π = M. R. T
Dans ces expressions:
n = Nombre de moles de particules dans la solution.
R = Constante de gaz universelle (8,314472 J. K-1 . Môle-1).
T = température en Kelvin.
M = molarité.
Les références
- Wikipédia. (s.f.). Propriétés colligatives. Récupéré de en.wikipedia.org
- AVANT JC. (s.f.). Propriétés colligatives. Récupéré de opentextbc.ca
- Bosma, W. B. (s.f.). Propriétés colligatives. Récupéré de chemistryexplained.com
- Sparknotes. (s.f.). Propriétés colligatives. Récupéré de sparknotes.com
- Université, F. S. (s.f.). Propriétés colligatives. Récupéré de chem.fsu.edu



Personne n'a encore commenté ce post.