
Propriétés de l'éther éthylique, structure, production, utilisations
le éther éthylique, également connu sous le nom d'éther diéthylique, c'est un composé organique dont la formule chimique est C4HdixO. Il se caractérise par être un liquide incolore et volatil, et par conséquent, ses bouteilles doivent être maintenues fermées aussi étroitement que possible.
Cet éther est classé comme membre des dialkyléthers; c'est-à-dire qu'ils ont la formule ROR ', où R et R' représentent différents segments de carbone. Et comme décrit par son deuxième nom, l'éther diéthylique, ce sont deux radicaux -éthyl qui se lient à l'atome d'oxygène.

L'éther éthylique a été initialement utilisé comme anesthésique général, introduit en 1846 par William Thomas Green Morton. Cependant, en raison de son inflammabilité, son utilisation a été abandonnée, le remplaçant par d'autres anesthésiques moins dangereux..
Ce composé a également été utilisé pour estimer le temps de circulation sanguine, lors de l'évaluation de l'état cardiovasculaire des patients..
Dans le corps, l'éther diéthylique peut être transformé en dioxyde de carbone et en métabolites; ces derniers finissent par être excrétés dans les urines. Cependant, la majeure partie de l'éther administré est expirée dans les poumons, sans subir aucune modification..
D'autre part, il est utilisé comme solvant pour les savons, les huiles, les parfums, les alcaloïdes et les gommes..
Index des articles
- 1 Structure de l'éther éthylique
- 1.1 Forces intermoléculaires
- 2 Propriétés physiques et chimiques
- 2.1 Autres noms
- 2.2 Formule moléculaire
- 2.3 Poids moléculaire
- 2.4 Apparence physique
- 2.5 Odeur
- 2.6 Saveur
- 2.7 Point d'ébullition
- 2.8 Point de fusion
- 2.9 Point d'éclair
- 2.10 Solubilité dans l'eau
- 2.11 Solubilité dans d'autres liquides
- 2.12 Densité
- 2.13 Densité de vapeur
- 2.14 Pression de vapeur
- 2.15 Stabilité
- 2.16 Auto-allumage
- 2.17 Décomposition
- 2.18 Viscosité
- 2.19 Chaleur de combustion
- 2.20 Chaleur de vaporisation
- 2.21 Tension superficielle
- 2.22 Potentiel d'ionisation
- 2.23 Seuil olfactif
- 2.24 Indice de réfraction
- 3 Obtention
- 3.1 De l'alcool éthylique
- 3.2 À partir d'éthylène
- 4 Toxicité
- 5 utilisations
- 5.1 Solvant organique
- 5.2 Anesthésie générale
- 5.3 Esprit de l'éther
- 5.4 Évaluation de la circulation sanguine
- 5.5 Laboratoires d'enseignement
- 6 Références
Structure de l'éther éthylique
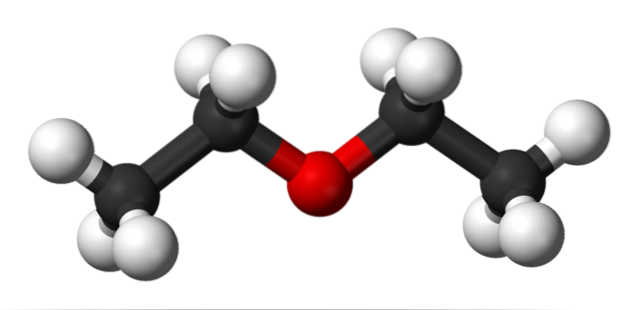
Dans l'image du haut, il y a une représentation avec un modèle de sphères et de barres de la structure moléculaire de l'éther éthylique..
Comme on peut le voir, la sphère rouge, correspondant à l'atome d'oxygène, a deux groupes éthyle liés de part et d'autre. Tous les liens sont simples, flexibles et tournent librement autour des axes σ.
Ces rotations donnent naissance à des stéréoisomères appelés conformères; que plus que des isomères, ce sont des états spatiaux alternatifs. La structure de l'image correspond exactement à l'anti conformère, dans lequel tous ses groupes d'atomes sont décalés (séparés les uns des autres).
Quel serait l'autre conformiste? L'éclipsé, et bien que son image ne soit pas disponible, il suffit de le visualiser en forme de U. Aux extrémités supérieures du U, les groupes méthyle, -CH3, qui subirait des répulsions stériques (heurterait dans l'espace).
Par conséquent, on s'attend à ce que la molécule CH3CHdeuxLCOdeuxCH3 adoptez l'anti façonnage la plupart du temps.
Forces intermoléculaires
Par quelles forces intermoléculaires les molécules d'éther éthylique en phase liquide sont-elles régies? Ils sont maintenus dans le liquide principalement grâce aux forces de dispersion, car leur moment dipolaire (1,5D) manque d'une région suffisamment déficiente en densité électronique (δ +)
C'est parce qu'aucun atome de carbone dans les groupes éthyle ne donne trop de densité électronique à l'atome d'oxygène. Ce qui précède est évident avec la carte de potentiel électrostatique de l'éther éthylique à portée de main (image du bas). Notez l'absence de zone bleue.
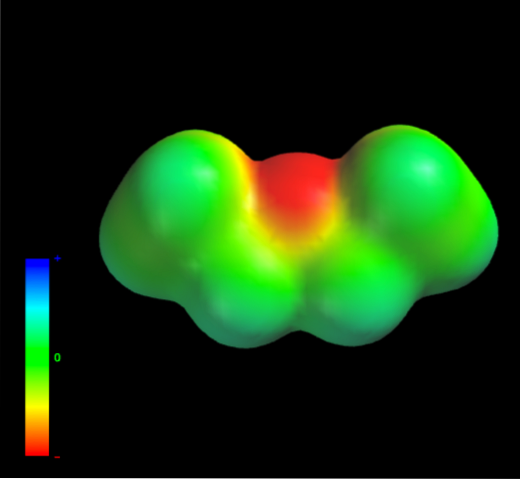
L'oxygène ne peut pas non plus former de liaisons hydrogène, encore une fois, car il n'y a pas de liaisons O-H disponibles dans la structure moléculaire. Ce sont donc les dipôles instantanés et leur masse moléculaire qui favorisent leurs forces de dispersion..
Malgré cela, il est très soluble dans l'eau. Parce que? Parce que son atome d'oxygène, avec une densité d'électrons plus élevée, peut accepter les liaisons hydrogène d'une molécule d'eau:
(CH3CHdeux)deuxOU ALORSδ- - δ+H-OH
Ces interactions sont responsables de la dissolution de 6,04 g de cet éther dans 100 ml d'eau.
Proprietes physiques et chimiques
Autres noms
-L'éther diéthylique
-Éthoxyéthane
-Oxyde d'éthyle
Formule moléculaire
C4HdixO ou (CdeuxH5)deuxOU ALORS.
Poids moléculaire
74,14 g / mol.
Aspect physique
Liquide incolore.
Odeur
Doux et épicé.
Goût
Brûlant et doux.
Point d'ébullition
94,3 ºF (34,6 ºC) à 760 mmHg.
Point de fusion
-177,3 ° F (-116,3 ° C). Cristaux stables.
point d'allumage
-49 ° F (contenant fermé).
Solubilité dans l'eau
6,04 g / 100mL à 25 ºC.
Solubilité dans d'autres liquides
Miscible avec les alcools aliphatiques à chaîne courte, le benzène, le chloroforme, l'éther de pétrole, les solvants gras, de nombreuses huiles et l'acide chlorhydrique concentré.
Soluble dans l'acétone et très soluble dans l'éthanol. Il est également soluble dans le naphta, le benzène et les huiles.
Densité
0,714 mg / mL à 68 ªF (20 ºC).
Densité de vapeur
2,55 (par rapport à l'air pris avec densité 1).
La pression de vapeur
442 mmHg à 68 ° F. 538 mmHg à 25 ° C 58,6 kPa à 20 ºC.
Stabilité
Il s'oxyde lentement sous l'action de l'air, de l'humidité et de la lumière avec la formation de peroxydes.
La formation de peroxydes peut se produire dans des conteneurs d'éther qui ont été ouverts et qui restent stockés pendant plus de six mois. Les peroxydes peuvent exploser par friction, impact ou chauffage.
Éviter tout contact avec: le zinc, les halogènes, les oxyhalogénures non métalliques, les agents oxydants puissants, le chlorure de chromyle, les huiles de témentine, les nitrates et chlorures métalliques.
Allumage automatique
356 ºF (180 ºC).
Décomposition
Lorsqu'il est chauffé, il se décompose, émettant une fumée âcre et irritante.
Viscosité
0,2448 cPois à 20 ºC.
Chaleur de combustion
8,807 Kcal / g.
Chaleur de vaporisation
89,8 cal / g à 30 ºC.
Tension superficielle
17,06 dynes / cm à 20 ° C.
Potentiel d'ionisation
9,53 eV.
Seuil d'odeur
0,83 ppm (la pureté n'est pas donnée).
Indice de réfraction
1355 à 15 ºC.
Obtention
De l'alcool éthylique
L'éther éthylique peut être obtenu à partir d'alcool éthylique, en présence d'acide sulfurique comme catalyseur. L'acide sulfurique en milieu aqueux se dissocie produisant l'ion hydronium, H3OU ALORS+.
L'alcool éthylique anhydre s'écoule à travers la solution d'acide sulfurique, chauffée entre 130 ° C et 140 ° C, produisant la protonation des molécules d'alcool éthylique. Par la suite, une autre molécule d'alcool éthylique non protonée réagit avec la molécule protonée.
Lorsque cela se produit, l'attaque nucléophile de la deuxième molécule d'alcool éthylique favorise la libération d'eau de la première molécule (la protonée); en conséquence, un éther éthylique protoné (CH3CHdeuxOHCHdeuxCH3), avec de l'oxygène chargé partiellement positif.
Cependant, cette méthode de synthèse perd en efficacité car l'acide sulfurique est progressivement dilué avec l'eau produite dans le procédé (produit de la déshydratation de l'alcool éthylique)..
La température de réaction est critique. À des températures inférieures à 130 ° C, la réaction est lente et l'alcool éthylique sera distillé en grande partie..
Au-dessus de 150 ºC, l'acide sulfurique provoque la formation d'éthylène (l'alcène à double liaison), au lieu de se combiner avec l'alcool éthylique pour former de l'éther éthylique.
De l'éthylène
Dans le processus inverse, c'est-à-dire l'hydratation de l'éthylène en phase vapeur, l'éther éthylique peut être formé comme sous-produit en plus de l'alcool éthylique. En fait, cette voie de synthèse produit l'essentiel de ce composé organique..
Ce procédé utilise des catalyseurs d'acide phosphorique attachés à un support solide, qui peut être ajusté pour produire plus d'éther..
La déshydratation en phase vapeur de l'éthanol en présence de catalyseurs d'alumine peut donner un rendement de 95% dans la production d'éther éthylique..
Toxicité
Peut provoquer une irritation de la peau et des yeux par contact. Le contact avec la peau peut provoquer un dessèchement et des gerçures. L'éther ne pénètre généralement pas dans la peau, car il s'évapore rapidement.
L'irritation oculaire causée par l'éther est généralement légère et en cas d'irritation sévère, les dommages sont généralement réversibles.
Son ingestion produit des effets narcotiques et une irritation de l'estomac. Une ingestion sévère peut endommager les reins.
L'inhalation d'éther peut provoquer une irritation du nez et de la gorge. En cas d'inhalation d'éther, les symptômes suivants peuvent survenir: somnolence, excitation, étourdissements, vomissements, respiration irrégulière et augmentation de la salivation..
Une exposition élevée peut entraîner une perte de conscience et même la mort.
L'OSHA fixe une limite d'exposition professionnelle aéroportée de 800 ppm en moyenne sur un quart de travail de 8 heures..
Niveaux d'irritation oculaire: 100 ppm (humain). Niveaux d'irritation oculaire: 1200 mg / m3 (400 ppm).
Applications
Solvant organique
C'est un solvant organique utilisé pour dissoudre le brome, l'iode et d'autres halogènes; la plupart des lipides (graisses), résines, caoutchoucs purs, certains alcaloïdes, gommes, parfums, acétate de cellulose, nitrate de cellulose, hydrocarbures et colorants.
De plus, il est utilisé dans l'extraction de principes actifs des tissus animaux et végétaux, car il a une densité inférieure à celle de l'eau et flotte dessus, laissant les substances souhaitées dissoutes dans l'éther..
Anesthésie générale
Il est utilisé comme anesthésique général depuis 1840, en remplacement du chloroforme car il présente un avantage thérapeutique. Cependant, il s'agit d'une substance inflammable, et rencontre donc de graves difficultés dans son utilisation en milieu clinique..
De plus, il produit certains effets secondaires postopératoires indésirables tels que des nausées et des vomissements chez les patients..
Pour ces raisons, l'utilisation de l'éther comme anesthésique général a été abandonnée, le remplaçant par d'autres anesthésiques tels que l'halothane..
Esprit éther
L'éther mélangé à de l'éthanol a été utilisé pour former la solution appelée esprit d'éther, utilisée dans le traitement des flatulences gastriques et des formes plus douces de gastralgie..
Évaluation de la circulation sanguine
L'éther a été utilisé pour évaluer la circulation sanguine entre un bras et les poumons. L'éther est injecté dans un bras, amenant le sang vers l'oreillette droite, puis le ventricule droit, et de là vers les poumons..
Le temps qui s'écoule de l'injection de l'éther, jusqu'à la capture de l'odeur de l'éther dans l'air expiré, est d'environ 4 à 6 s.
Laboratoires d'enseignement
L'éther est utilisé dans les laboratoires d'enseignement dans de nombreuses expériences; par exemple, dans la démonstration des lois de la génétique de Mendel.
L'éther est utilisé pour endormir les mouches du genre Drosophila et permettre les croisements nécessaires entre elles, mettant ainsi en évidence les lois de la génétique
Les références
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (dixe édition.). Wiley plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Le Sevier. (2018). L'éther diéthylique. Science Direct. Récupéré de: sciencedirect.com
- Les rédacteurs de l'Encyclopaedia Britannica. (2018). Éther éthylique. ncyclopædia Britannica. Récupéré de: britannica.com
- PubChem (2018). Éther. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Wikipédia. (2018). L'éther diéthylique. Récupéré de: en.wikipedia.org
- Fiche de sécurité XI: éther éthylique. [PDF]. Récupéré de: quimica.unam.mx
Personne n'a encore commenté ce post.