
Structure, propriétés, nomenclature et utilisations des alcools
Les alcools ce sont des composés organiques caractérisés en ce qu'ils ont un groupe hydroxyle (-OH) lié à un carbone saturé; c'est-à-dire un carbone lié à quatre atomes par des liaisons simples (sans doubles ou triples liaisons).
La formule générique de cette vaste et polyvalente famille de composés est ROH. Pour être considéré comme un alcool au sens strictement chimique, le groupe OH doit être le plus réactif de la structure moléculaire. Ceci est important pour pouvoir affirmer, parmi plusieurs molécules à groupements OH, laquelle d'entre elles est un alcool..

L'un des alcools par excellence et le plus connu dans la culture populaire est l'alcool éthylique ou l'éthanol, CH3CHdeuxOH. En fonction de leur origine naturelle, et donc de leur environnement chimique, leurs mélanges peuvent engendrer un spectre illimité de saveurs; certains, qui montrent même des changements positifs au palais avec la mouche des années.
Ce sont les mélanges de composés organiques et inorganiques avec l'alcool éthylique, ce qui donne lieu à sa consommation lors d'événements sociaux et religieux depuis des temps avant Jésus-Christ; comme avec du vin de raisin, ou avec des verres servis pour une fête, en plus des punchs, des bonbons, des panettones, etc..
Le plaisir de ces boissons, avec modération, est le résultat de la synergie entre l'alcool éthylique et sa matrice chimique enveloppante; sans elle, en tant que substance pure, elle devient extrêmement dangereuse et déclenche une série de conséquences négatives sur la santé.
C'est pour cette raison que la consommation de mélanges aqueux de CH3CHdeuxL'OH, comme ceux achetés en pharmacie à des fins antiseptiques, représente un grand risque pour l'organisme.
D'autres alcools qui sont également très populaires sont le menthol et le glycérol. Ce dernier, ainsi que l'érythrole, se retrouve comme additif dans de nombreux aliments pour les sucrer et les conserver pendant le stockage. Il existe des entités gouvernementales qui dictent quels alcools peuvent être utilisés ou consommés sans effets collatéraux..
Laissant derrière l'usage quotidien des alcools, ce sont chimiquement des substances très polyvalentes, car à partir d'elles, d'autres composés organiques peuvent être synthétisés; au point que certains auteurs pensent qu'avec une dizaine d'entre eux tous les composés nécessaires peuvent être créés pour vivre sur une île déserte.
Index des articles
- 1 Structure des alcools
- 1.1 Caractère amphiphile
- 1.2 Structure de R
- 2 Propriétés physiques et chimiques
- 2.1 Point d'ébullition
- 2.2 Capacité de solvant
- 2.3 Amphotéricisme
- 3 Nomenclature
- 3.1 Nom commun
- 3.2 Système IUPAC
- 4 Synthèse
- 4.1 Hydratation des alcènes
- 4.2 Processus Oxo
- 4.3 Fermentation des glucides
- 5 utilisations
- 5.1 Boissons
- 5.2 Matière première chimique
- 5.3 Solvants
- 5.4 Carburants
- 5.5 Antiseptiques
- 5.6 Autres utilisations
- 6 Références
Structure des alcools
Les alcools ont une formule générale de ROH. Le groupe OH est lié au groupe alkyle R, dont la structure varie d'un alcool à l'autre. L'union entre R et OH se fait par une seule liaison covalente, R-OH.
L'image suivante montre trois structures génériques pour les alcools, en gardant à l'esprit que l'atome de carbone est saturé; c'est-à-dire qu'il forme quatre liens simples.
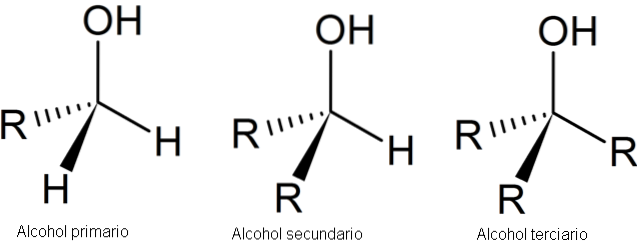
Comme on peut le voir, R peut être n'importe quel squelette carboné tant qu'il n'a pas de substituants plus réactifs que le groupe OH..
Pour le cas de l'alcool primaire, dans un premier temps, le groupe OH est lié à un carbone primaire. Ceci est facilement vérifié en observant que l'atome au centre du tétraèdre gauche est lié à un R et deux H.
L'alcool secondaire, 2º, est vérifié avec le carbone du tétraèdre au centre maintenant lié à deux groupes R et un H.
Et enfin, il y a l'alcool tertiaire, 3º, avec le carbone lié à trois groupes R.
Caractère amphiphile
Selon le type de carbone lié à l'OH, il y a la classification des alcools primaires, secondaires et tertiaires. Dans les tétraèdres, les différences structurelles entre eux ont déjà été détaillées. Mais, tous les alcools, quelle que soit leur structure, ont quelque chose en commun: le caractère amphiphile..
Vous n'avez pas besoin de vous adresser à une structure pour la remarquer, juste sa formule chimique ROH. Le groupe alkyle est composé presque entièrement d'atomes de carbone, "assemblant" un squelette hydrophobe; c'est-à-dire qu'il interagit très faiblement avec l'eau.
D'autre part, le groupe OH peut former des liaisons hydrogène avec des molécules d'eau, étant ainsi hydrophile; c'est-à-dire aime ou a une affinité pour l'eau. Ainsi, les alcools ont un squelette hydrophobe, attaché à un groupe hydrophile. Ils sont à la fois apolaires et polaires, ce qui revient à dire que ce sont des substances amphiphiles.
R-OH
(Hydrophobe) - (Hydrophile)
Comme cela sera expliqué dans la section suivante, le caractère amphiphile des alcools définit certaines de leurs propriétés chimiques..
Structure de R
Le groupe alkyle R peut avoir n'importe quelle structure, et pourtant il est important car il permet de cataloguer les alcools.
Par exemple, R peut être une chaîne ouverte, comme c'est le cas avec l'éthanol ou le propanol; ramifié, comme l'alcool t-butylique, (CH3)deuxCHCHdeuxOH; il peut être cyclique, comme dans le cas du cyclohexanol; ou il peut avoir un cycle aromatique, comme dans l'alcool benzylique, (C6H5) CHdeuxOH, ou dans le 3-phénylpropanol, (C6H5) CHdeuxCHdeuxCHdeuxOh.
La chaîne R peut même avoir des substituants tels que des halogènes ou des doubles liaisons, comme pour les alcools 2-chloroéthanol et 2-butén-1-ol (CH3CHdeux= CHCHdeuxOH).
Considérant alors la structure de R, la classification des alcools devient complexe. Pour cette raison, la classification basée sur leur structure (1er, 2ème et 3ème alcools) est plus simple mais moins spécifique, même si elle suffit à expliquer la réactivité des alcools..
Proprietes physiques et chimiques
Point d'ébullition
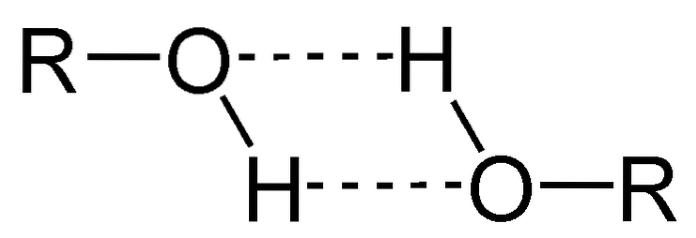
L'une des principales propriétés des alcools est qu'ils s'associent par des liaisons hydrogène.
Dans l'image ci-dessus, vous pouvez voir comment deux molécules ROH forment des liaisons hydrogène l'une avec l'autre. Grâce à cela, les alcools sont généralement des liquides à point d'ébullition élevé..
Par exemple, l'alcool éthylique a un point d'ébullition de 78,5 ° C. Cette valeur augmente à mesure que l'alcool devient plus lourd; c'est-à-dire que le groupe R a une plus grande masse ou un plus grand nombre d'atomes. Ainsi, l'alcool n-butylique, CH3CHdeuxCHdeuxCHdeuxOH, a un point d'ébullition de 97 ° C, légèrement inférieur à celui de l'eau.
Le glycérol est l'un des alcools dont le point d'ébullition est le plus élevé: 290 ° C.
Parce que? Parce que non seulement la masse ou la structure de R influence, mais aussi le nombre de groupes OH. Le glycérol a trois OH dans sa structure: (HO) CHdeuxCH (OH) CHdeux(OH). Cela le rend capable de former de nombreuses liaisons hydrogène et de maintenir ses molécules ensemble plus étroitement..
D'autre part, certains alcools sont solides à température ambiante; comme le même glycérol à une température inférieure à 18 ° C. Par conséquent, l'affirmation selon laquelle tous les alcools sont des substances liquides est incorrecte..
Capacité de solvant
Dans les maisons, il est très courant de recourir à l'alcool isopropylique pour éliminer une tache difficile à éliminer sur une surface. Cette capacité de solvant, très utile pour la synthèse chimique, est due à son caractère amphiphile, expliqué précédemment.
Les graisses se caractérisent par leur hydrophobie: c'est pourquoi il est difficile de les éliminer avec de l'eau. Cependant, contrairement à l'eau, les alcools ont une part hydrophobe dans leur structure.
Ainsi, son groupe alkyle R interagit avec les graisses, tandis que le groupe OH forme des liaisons hydrogène avec l'eau, aidant à les déplacer..
Amphotéricisme
Les alcools peuvent réagir sous forme d'acides et de bases; c'est-à-dire que ce sont des substances amphotères. Ceci est représenté par les deux équations chimiques suivantes:
ROH + H+ => ROHdeux+
ROH + OH- => RO-
RO- est la formule générale de ce que l'on appelle un alcoxyde.
Nomenclature
Il existe deux façons de nommer les alcools, dont la complexité dépendra de leur structure.
Nom comun
Les alcools peuvent être appelés par leurs noms communs. Quels sont? Pour cela, il faut connaître le nom du groupe R auquel s'ajoute la terminaison -ico et précédé du mot «alcool». Par exemple, le CH3CHdeuxCHdeuxOH est l'alcool propylique.
D'autres exemples sont:
-CH3OH: alcool méthylique
-(CH3)deuxCHCHdeuxOH: alcool isobutylique
-(CH3)3COH: alcool tert-butylique
Système IUPAC
Quant aux noms communs, il faut commencer par identifier R. L'avantage de ce système est qu'il est beaucoup plus précis que l'autre..
R, étant un squelette carboné, peut avoir des branches ou plusieurs chaînes; la chaîne la plus longue, c'est-à-dire avec le plus d'atomes de carbone, est celle qui recevra le nom d'alcool.
Au nom de l'alcane de la plus longue chaîne, la terminaison «l» est ajoutée. C'est pourquoi au CH3CHdeuxOH s'appelle éthanol (CH3CHdeux- + OH).
En général, l'OH doit avoir le plus petit dénombrement possible. Par exemple, le BrCHdeuxCHdeuxCHdeux(OH) CH3 est appelé 4-Bromo-2-butanol, et non 1-Bromo-3-butanol.
La synthèse
Hydratation alcène
Le processus de craquage de l'huile produit un mélange d'alcènes de quatre ou cinq atomes de carbone, qui peuvent être facilement séparés.
Ces alcènes peuvent être transformés en alcools par l'addition directe d'eau ou par la réaction de l'alcène avec l'acide sulfurique, suivie de l'addition de l'eau qui clive l'acide, à l'origine de l'alcool..
Processus Oxo
En présence d'un catalyseur approprié, les alcènes réagissent avec le monoxyde de carbone et l'hydrogène pour générer des aldéhydes. Les aldéhydes peuvent être facilement réduits en alcools par une réaction d'hydrogénation catalytique.
Souvent, il y a une telle synchronisation du processus oxo que la réduction des aldéhydes est presque simultanée avec leur formation..
Le catalyseur le plus utilisé est le dicobalt octocarbonyle, obtenu par réaction entre le cobalt et le monoxyde de carbone.
Fermentation glucidique
La fermentation des glucides par la levure est toujours d'une grande importance dans la production d'éthanol et d'autres alcools. Les sucres proviennent de la canne à sucre ou de l'amidon obtenu à partir de différents grains. Pour cette raison, l'éthanol est également appelé «alcool de grain»
Applications
Boissons
Bien que ce ne soit pas la fonction principale des alcools, la présence d'éthanol dans certaines des boissons est l'une des connaissances les plus populaires. Ainsi, l'éthanol, produit de la fermentation de la canne à sucre, du raisin, des pommes, etc., est présent dans de nombreuses boissons à usage social.
Matière première chimique
-Le méthanol est utilisé dans la production de formaldéhyde, grâce à son oxydation catalytique. Le formaldéhyde est utilisé dans la fabrication de plastiques, peintures, textiles, explosifs, etc..
-Le butanol est utilisé dans la production d'éthanoate de butane, un ester utilisé comme arôme dans l'industrie alimentaire et de la confiserie..
-L'alcool allylique est utilisé dans la production d'esters, y compris le phtalate de diallyle et l'isophtalate de diallyle, qui servent de monomères.
-Le phénol est utilisé dans la production de résines, la fabrication de nylon, les déodorants, les cosmétiques, etc..
-Des alcools à chaîne droite de 11 à 16 atomes de carbone sont utilisés comme intermédiaires pour obtenir des plastifiants; par exemple, polychlorure de vinyle.
-Les alcools dits gras sont utilisés comme intermédiaires dans la synthèse de détergents.
Solvants
-Le méthanol est utilisé comme diluant pour peinture, tout comme le 1-butanol et l'alcool isobutylique.
-L'alcool éthylique est utilisé comme solvant pour de nombreux composés insolubles dans l'eau, utilisé comme solvant dans les peintures, les cosmétiques, etc..
-Les alcools gras sont utilisés comme solvants dans l'industrie textile, dans les colorants, dans les détergents et dans les peintures. L'isobutanol est utilisé comme solvant dans les matériaux de revêtement, les peintures et les adhésifs.
Carburants
-Le méthanol est utilisé comme carburant dans les moteurs à combustion interne et comme additif pour l'essence pour améliorer la combustion.
-L'alcool éthylique est utilisé en combinaison avec des combustibles fossiles dans les véhicules à moteur. A cet effet, de vastes régions du Brésil sont destinées à la culture de la canne à sucre pour la production d'alcool éthylique. Cet alcool présente l'avantage de ne produire que du dioxyde de carbone lors de sa combustion..
Lorsque l'alcool éthylique est brûlé, il produit une flamme propre et sans fumée, c'est pourquoi il est utilisé comme combustible dans les cuisines de campagne..
-L'alcool gélifié est produit en combinant du méthanol ou de l'éthanol avec de l'acétate de calcium. Cet alcool est utilisé comme source de chaleur dans les poêles de campagne, et comme il se répand, il est plus sûr que les alcools liquides.
-Le soi-disant biobutanol est utilisé comme carburant dans les transports, ainsi que l'alcool isopropylique qui peut être utilisé comme carburant; bien que son utilisation ne soit pas recommandée.
Antiseptiques
L'alcool isopropylique à une concentration de 70% est utilisé comme antiseptique externe pour éliminer les germes et retarder leur croissance. De même, l'alcool éthylique est utilisé à cette fin..
Autres utilisations
Le cyclohexanol et le méthylcyclohexanol sont utilisés dans la finition des textiles, la transformation des meubles et les détachants.
Les références
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (dixe édition.). Wiley plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Morrison et Boyd. (1987). Chimie organique. (Cinquième édition). Addison-Wesley Iberoamericana.
- Dr JA Colapret. (s.f.). Les alcools. Récupéré de: colapret.cm.utexas.edu
- Partenariat pour l'éducation en pharmacologie de l'alcool. (s.f.). Qu'est-ce que l'alcool? Université de Duke. Récupéré de: sites.duke.edu
- Whittemore F. (s.f.). Types et utilisations d'alcool. Récupéré de: livestrong.com
- Wikipédia. (2018). De l'alcool. Récupéré de: en.wikipedia.org


Personne n'a encore commenté ce post.